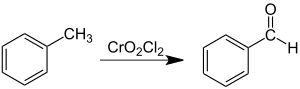
Реакция Этара
Реакция Этара — окисление метильной группы метилзамещенных ароматических соединений действием хромилхлорида:
Реакцию проводят в инертном растворителе (сероуглерод, метиленхлорид), добавляя к раствору алкилароматического соединения раствор хлористого хромила в двойном избытке, при этом выпадает коричневый осадок т. н. «комплекса Этара», содержащего два эквивалента хромилхлолрида. Комплекс Этара затем разлагают водой, получая альдегид. Выходы в некоторых случаях превышают 80%, однако существенно колеблются в зависимости от природы заместителей и условий проведения реакции.
Иногда реакцией Этара называют окисление хлористым хромилом и других органических соединений (алкилароматических, алкенов и т.п.).
Метод был предложен А. Л. Этаром в 1877 г., использовавшим его для окисления цимола в соответствующий альдегид[1] и затем для окисления замещенных толуолов в бензальдегиды[2].
Механизм реакции
Детальный механизм реакции и строение комплексов Этара окончательно не выяснены.
Кинетические данные показывают, что реакция является реакцией первого порядка и по метиларену, и по хромилхлориду, таким образом, стадией, определяющей скорость реакции является медленное присоединение одной молекулы хромилхлорида с быстрым присоединением второй и образованием комплекса Этара. В случае метилбензолов в качестве промежуточного продукта первоначально были предложены дизамещенные по метилу соединения - с четырехвалентным и шестивалентным хромом:
Сам Этар предполагал, что оба атома хрома в комплексах четырехвалентны и они формально являются диацилалем бензальдегида, гидролиз которого образует сам бензальдегид[3].
Исследования комплексов Этара методом электронной спин-резонансной спектроскопии показали, что один из атомов хрома в этих комплексах является диамагнитным и, следовательно, шестивалентным, а второй - парамагнитным, т.е., вероятно, четырехвалентным и связанным с атомом Cr(VI) кислородным мостиком; в пользу этой структуры говорит тот факт, что при разложении комплексов Этара избытком диоксида серы образуются бензиловые спирты, гладко окисляющиеся в альдегиды избытком Cr(VI)[4]. Реакция разложения комплексов идет, вероятно, по сольволитическому механизму SN1, дополнительным подтверждением такого механизма является выделение ацетата бензгидрола при разложении комплексов Этара уксусной кислотой, содержащей SO2[3].
В настоящее время этот механизм считается наиболее вероятным[5].
Применимость и модификации
Окисление алкилароматических соединений
Обзор (мини), в т.ч. моно- и бимолекулярные варианты[6] Пропилбензол, продукты[7]
Окисление алкенов
В отличие от алкилароматических соединений, образующих c хромилхлоридом комплексы Этара в молярном отношении 1:2, алкены образуют комплексы 1:1, дальнейший гидролиз этих комплексов в присутствии водного метабисульфита натрия ведет к смеси продуктов - хлоргидринов и 1-хлоркетонов[8].
Терминальные алкены могут быть окислены взаимодействием с хромилхлоридом и последующим восстановлением реакционной смеси цинковой пылью до альдегидов с препаративными выходами:
- R1R2C=CH2 R1R2CH-CHO
Для такого окисления используют эквимолярное по отношению к алкену количество хромилхлорида, реакцию проводят в растворе при охлаждении (0–5°) в растворе метиленхлорида, добавляя к раствору алкена сначала раствор хромилхлорида, а затем цинковую пыль и воду. В реакцию вступают как 2,2-замещенные алифатические алкены (2,4,4-триметил-1-пентен), так и 2,2-замещенные винилбензолы (2-фенилпропаналь, 1,1-дифенилэтилен), выходы составляют от ~60% для ароматических до 70-80% для алифатических альдегидов[9].
Взаимодействие с циклоалкенами в ацетоне при -70 °C - 1-хлоркетоны, при этом циклододецен образует с выходом 79% 1-хлордодеканон, который может быть далее восстановлен цинковой пылью в уксусной кислоте с выходом 96% до циклододеканона[10].
При проведении реакции в присутствии ацетилхлорида алкены хлоргидринный интермедиат ацилируется in situ с образованием ацетилхлоргидринов[11].
Взаимодействие с O-силилированными енолами ведет к региоселективному образованию α-гидроксикетонов[12].
Примечания
- Étard, A. Sur la synthèse des cétones aromatiques; essence de cumin (фр.) // Comptes-rendus hebdomadaires des Séances de l'Académie des Sciences. — 1880. — Т. 90. — С. 534. Архивировано 1 марта 2012 года.
- Étard, A. Recherches sur le rôle oxydant de l'acide chlorochromique (фр.) // Annales de Chimie et de Physique. — 1881. — Т. 22. — С. 218—286. Архивировано 1 марта 2012 года.
- Necşoiu, I.; Przemetchi, V.; Ghenciulescu, A.; Rentea, C. N.; Nenitzescu, C. D. Étard reaction—II1: Structure of the chromyl chloride complexes of phenylmethanes (англ.) // Tetrahedron : journal. — 1966. — 1 January (vol. 22, no. 9). — P. 3037—3045. — ISSN 0040-4020. — doi:10.1016/S0040-4020(01)82283-3. Архивировано 19 октября 2016 года.
- Necsoiu, Ileana; Balaban, A. T.; Pascaru, I.; Sliam, Elvira; Elian, M.; Nenitzescu, C. D. The mechanism of the etard reaction (неопр.) // Tetrahedron. — 1963. — 1 January (т. 19, № 7). — С. 1133—1142. — ISSN 0040-4020. — doi:10.1016/S0040-4020(01)98572-2.
- Li, Jie Jack. Name Reactions: A Collection of Detailed Reaction Mechanisms (англ.). — Springer Science & Business Media, 2003. — P. 129. — ISBN 978-3-540-40203-9.
- Cainelli, G.; Cardillo, G. Chromium Oxidations in Organic Chemistry (неопр.). — Springer Science & Business Media, 2012. — С. 33—41. — ISBN 978-3-642-69362-5.
- Wiberg, K. B.; Marshall, B.; Foster, G. Some observations on the Étard reaction (англ.) // Tetrahedron Letters : journal. — 1962. — Vol. 3, no. 8. — P. 345–348. — doi:10.1016/s0040-4039(00)70878-1.
- Stairs, R. A.; Diaper, D. G. M.; Gatzke, A. L. Reaction of chromyl chloride with some olefins: Part I. The products from cyclohexene, cyclopentene, 1-hexene, and 2-methyl-1-pentene (англ.) // Canadian Journal of Chemistry : journal. — 1963. — Vol. 41, no. 5. — P. 1059—1064.
- Aldehydes by oxidation of terminal olefins with chromyl chloride: 2,4,4-trimethylpentanal (англ.) // Organic Syntheses : journal. — 1971. — Vol. 51. — P. 4. — ISSN 23333553 00786209, 23333553. — doi:10.15227/orgsyn.051.0004.
- Sharpless, K. Barry; Teranishi, Allan Y. Chromyl chloride in acetone. α-Chloro ketones and ketones directly from olefins (англ.) // The Journal of Organic Chemistry : journal. — 1973. — Vol. 38, no. 1. — P. 185—186. — ISSN 0022-3263. — doi:10.1021/jo00941a054.
- Ba̋ckvall, J. E.; Young, M. W.; Sharpless, K. B. Vicinal acetoxychlorination of olefins by chromyl chloride in acetyl chloride (англ.) // Tetrahedron Letters : journal. — 1977. — 1 January (vol. 18, no. 40). — P. 3523—3526. — ISSN 0040-4039. — doi:10.1016/S0040-4039(01)83282-2.
- Lee, Thomas V; Toczek, Judy. The reaction of chromyl chloride and O-silylated enolates: a novel regiospecific route to α-hydroxy ketones (англ.) // Tetrahedron Letters : journal. — 1982. — January (vol. 23, no. 28). — P. 2917—2920. — ISSN 00404039. — doi:10.1016/S0040-4039(00)88448-8.