Гидрид бериллия
Гидрид бериллия — химическое соединение бериллия и водорода. Представляет собой твёрдое аморфное вещество белого цвета. В сухом воздухе достаточно стабильно, во влажном — быстро разлагается[1].
| Гидрид бериллия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Гидрид бериллия |
| Хим. формула | BeН2 |
| Рац. формула | BeН2 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 11,02806 г/моль |
| Плотность | 0,65 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | 125 °C |
| Мол. теплоёмк. | 30,124 Дж/(моль·К) |
| Энтальпия | |
| • образования | 4234,208 кДж/моль |
| Классификация | |
| Рег. номер CAS | 7787-52-2 |
| PubChem | 139073 |
| SMILES | |
| InChI | |
| ChEBI | 33787 |
| ChemSpider | 17215712 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение и свойства
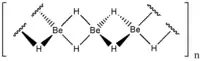
В отличие от других гидридов элементов II группы, в которых водород и элемент связаны ионной связью, в гидриде бериллия связь между водородом и бериллием ковалентная[2] (двухэлектронная трёхцентровая связь)[3].
Гидрид бериллия, как правило, образуется в виде аморфного твердого вещества, но при его нагревании под давлением (в присутствии 0,5-2,5 % LiH как катализатора) образуется гексагональная кристаллическая форма с более высокой плотностью (~ 0,78 г/см3).[4]
Получить гидрид бериллия прямым взаимодействием металлического бериллия и водородом невозможно, поэтому его получают непрямыми методами. Впервые гидрид бериллия был синтезирован в 1951 г. путём взаимодействия раствора диметилбериллия в диэтиловом эфире с алюмогидридом лития:[1]
Другой метод получения ВеН2 — термическое разложение (при температурах от 200 до 250° С) металлорганических соединений бериллия, в том числе диметилбериллия[1] и ди(третбутил)бериллия[5]:
Гидрид бериллия высокой чистоты получается в результате реакции трифенилфосфина боргидридом бериллия:[6]
Химические свойства
Гидрид бериллия при нагревании до 125°С разлагается на бериллий и газообразный водород:
Вода разлагает гидрид бериллия на гидроксид бериллия и свободный водород:
В токе чистого кислорода быстро окисляется (иногда с воспламенением):
При нагревании взаимодействует с гидроксидами щелочных металлов, с образованием твердых бериллатов и газообразного водорода:
Применение
- Гидрид бериллия находит применение в качестве ракетного топлива.[7]
- Достаточно перспективно его использование в органическом синтезе в качестве избирательного катализатора и/или восстановителя.
Примечания
- Химия и технология редких и рассеянных элементов: Учеб. пособие для вузов: Ч. I / Под ред. К. А. Большакова. — 2-е изд., перераб. и доп.- М.: Высшая школа, 1976. — С.176.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- А. Дубов. Квантовый компьютер рассчитал структуру гидрида бериллия
- Brendel G. J., Marlett E. M., Niebylski L. M. Crystalline beryllium hydride. — Inorganic Chemistry (journal). — 1978. — Vol. 17/ — P. 3589-3592
- Coates G. E. and Glockling F. Di-tert.-butylberyllium and beryllium hydride. — J. Chem. — 1954. Soc.: 2526—2529.
- Greenwood N. N., Earnshaw A. Chemistry of the Elements (2nd ed.). — Oxford: Butterworth-Heinemann, 1997.- P. 115. — ISBN 0-08-037941-9
- Сарнер С. Химия ракетных топлив = Propellant chemistry. — М.: Мир, 1969. — 488 с.