Биоактивное стекло
Биоакти́вное стекло́ (также биостекло́) — биологически активный материал, на основе силикатного стекла, состоящий из стекловидной матрицы и микрокристаллов, применяемый для восстановления костей. Биоактивные стёкла относятся к керамике, способной взаимодействовать с тканями организма[1]. После интеграции, контактируя со слюной или любой физиологической жидкостью, биостёкла способствуют образованию слоя карбонизированного гидроксиапатита и активации эндогенной реминерализации повреждённой ткани[2].

Биоактивные стёкла в основном производят из диоксида кремния с добавлением других оксидов. Наиболее известным составом биостекла является Bioglass 45S5, получаемый из диоксида кремния, оксида натрия, оксида кальция и пентаоксида фосфора. Последние разработки позволяют получать биоактивные стёкла на основе оксида бора[3] и использовать полиэфирные добавки[4].
Изобретения
Bioglass
Изобрёл биоактивное стекло американский учёный Ларри Хенч (англ. Larry L. Hench). Под впечатлением от случайного разговора с полковником, недавно вернувшимся с вьетнамской войны, о недостатке медицинских технологий, помогающих спасать конечности раненых, Хенч занялся работой по созданию биоматериалов, которые не отторгались бы человеческим организмом. Способы реконструкции повреждённых костных тканей с помощью имплантатов были известны, но проблема состояла в материале для имплантата, который должен быть биологически совместимым с тканью. Изначально предпочтение отдавалось биологически инертным материалам — коррозионно-стойким металлам, пластмассам и керамике. Такие материалы как титан и его сплавы, нержавеющая сталь, керамика нетоксичны и устойчивы к биохимическим воздействиям организма. Однако биоинертные материалы не нашли широкого применения в реконструктивно-восстановительной хирургии по причине отсутствия биоактивных покрытий, исключающих неизбежные реакции отторжения[5].

Команда Хенча выяснила, что гидроксиапатит образует чрезвычайно прочную связь со скелетом и является основной минеральной составляющей костей. Опыты с различными составами на основе гидроксиапатита позволили обнаружить, что он стимулирует остеогенез и играет важную роль в регуляции кальций-фосфатного обмена в организме, и что искомые свойства можно получить если придать материалу форму стекла пористой структуры[6].
В 1969 году был получен образец стекла с молекулярно-весовым соотношением компонентов: , названного позднее Bioglass 45S5. Тед Гринли, доцент кафедры ортопедической хирургии в Университете Флориды, имплантировал образцы крысам. Через шесть недель Гринли позвонил Хенчу и сообщил, что образцы невозможно извлечь обратно[2].
Таким образом, Ларри Хенч смог добиться результата, при котором полученный материал настолько прочно интегрировался с костью, что его нельзя было удалить, не повредив кость[7]. Хенч опубликовал свою первую работу на эту тему в 1971 году в издании Journal of Biomedical Materials Research. Его лаборатория продолжала работать над проектом в течение следующих 10 лет при постоянном финансировании от армии США. К 2006 году учёными по всему миру было опубликовано уже более 500 статей на тему биоактивных стёкол[2].
Развитие науки
После открытия биоактивного стекла в 1969 году ряд исследователей инициировали серию международных симпозиумов по биоматериалам, посвящённых главным образом материалам для реконструктивной хирургии. По мере того как эти симпозиумы становились все более популярными, возникла идея создания специализированной организации по биоматериалам. The Society For Biomaterials было официально учреждено в США в апреле 1974 года[8]. В марте 1976 года аналогичное общество (The European Society for Biomaterials) было создано в Европе[9].
Этапы развития биостекла условно разделяют на четыре периода[10]:
- эпоха открытий (1969—1979 годы);
- эпоха клинического применения (1980—1995 годы);
- эпоха регенерации тканей (1995—2005 годы);
- эпоха инноваций (2005 — последующие годы).
До 1980-х годов исследования фокусировались на использовании биостекла в ортопедии и стоматологии для лечения дефектов костей, возникающих в результате травм или заболеваний. Дальнейшие исследования показали, что продукты растворения, возникающие в результате деградации биостекла, способны стимулировать не только процесс остеогенеза, но и хондрогенез, который приводит к образованию хряща. Взаимодействие биостекла с мягкими соединительными тканями была впервые продемонстрирована в 1981 году исследовательской группой доктора Джона Уилсона[11].
Боратные стёкла
Базовые составы, применяемые для создания новых рецептур изготовления биоактивного стекла, в основном основывались на матрице из диоксида кремния. Большинство коммерческих биоактивных стекол содержат его в качестве основного компонента. Механизм связывания в таких биостеклах на основе силикатов заключается в частичном растворении благодаря присутствию оксидов-модификаторов ( и ), что приводит к образованию слоя силикагеля и последующей преципитации слоя фосфата кальция. При исследовании других стеклообразующих компонентов были рассмотрены боратные стекла. Они относительно легкоплавки, обладают значительно меньшей, чем силикатные стёкла, вязкостью и характеризуются модулем упругости, наибольшим для стёкол с высоким содержанием щелочных оксидов. С появлением чистых боратных стёкол началось их изучение в целях использования в биомедицинских практиках[12].
Марина Ричард (англ. Marina Nathalie Camille Richard) первая исследовала замену на в составе биостекла[12]. В 2000 году Ричард исследовала скорость образования гидроксиапатита для первого боратного стекла в составе, аналогичном 45S5, но без диоксида кремния, в сравнении с базовым составом стекла 45S5 с небольшим содержанием кристаллической фазы. Для оценки образования гидроксиапатита на стекле был смоделирован бесклеточный процесс. Процесс включал реакцию частиц боратного стекла в фосфатном растворе различной молярности при температуре 37 °C. Образование гидроксиапатита лучше всего наблюдалось в 0,1 М растворе фосфата для обоих стёкол. Продукты реакции были исследованы с использованием рентгеновской дифракции, инфракрасной спектроскопии, сканирующей электронной микроскопии,энергодисперсионной спектроскопии и масс-спектрометрии с индуктивно-связанной плазмой. Результаты работы бесклеточной модели были положительными, и за ними последовали дальнейшие исследования боратного биостекла. С использованием костных клеток MC3T3-E1 были проведены эксперименты in vivo, которые успешно продемонстрировали рост тканей кости вокруг частиц боратного стекла, очень похожий на рост тканей в образце стекла Хенча состава 45S5. Успешная биологическая активность, полученная с первой композицией стекла без диоксида кремния, была взята за основу для получения других композиций[3][12].
Исследователи из Миссурийского университета науки и технологий Стив Юнг (англ. Steve Jung) и Делберт Дэй (англ. Delbert Day) испытывали действие биоактивного стекла различного состава на биологические жидкости (в частности, кровь). Один из образцов боратного биостекла, получивший название 13-93B3, содержал оксид кальция. В его состав в массовом эквиваленте входили следующие компоненты[13]: .
Новое изобретение было основано на способности организма образовывать волокна особого белка — фибрина — на повреждённых тканях, которые останавливают тромбоциты и являются скелетом образующегося тромба. Целью проекта стало создание биостекла, имитирующее микроструктуру фибринового сгустка. Из состава 13-93B3 учёные изготовили нановолокна размером от 300 нм до 5 мкм, обладающие высокой пластичностью. Новый материал получил название DermaFuse[13].
После испытаний на лабораторных животных в 2011 году были проведены клинические испытания в Региональном медицинском центре округа Фелпс (Миссури, США) на пациентах с угрозой ампутации конечностей из-за инфицирования ран. У некоторых пациентов были язвы на венах голени, которые не заживали более года. Для лечения ран применялись прокладки из нановолокон DermaFuse. У всех двенадцати пациентов, больных диабетом и имеющих показания к ампутации, отмечались значительные улучшения и заживления ран практически без образования рубцов. Кроме того, DermaFuse оказался губительным для бактерий кишечной палочки, сальмонеллы и стафилококков[14].
Полиэфирные компоненты

Ограничивающими фактороми в использовании биоактивных стёкол являются их низкая прочность, хрупкость и ударная вязкость, что не позволяет их использовать для создания крупных нагружаемых изделий.
в 2016 году команда исследователей из Имперского колледжа Лондона и Миланского университета Бикокка разработала новое биостекло, отличающееся способностью к переносу веса и амортизации, имитируя таким образом физические качества живой хрящевой ткани. В его составе применяется кварц и поликапролактон — биоразлагаемый полиэфир с низкой температурой плавления. Физические свойства поликапролактона очень близки к свойствам хрящевой ткани, он обладает достаточной гибкостью и прочностью. Отпечатанные при помощи 3D-принтера необходимые по форме структуры после введения усиливают рост и регенерацию хрящевых клеток. Биоразлагаемый имплантат позволяет выдерживать вес пациента и обеспечивает возможность ходить без необходимости в дополнительных металлических пластинах или других имплантатах[15][4].
Генетическая теория
С помощью биостекла учёные также пытаются найти решения к задаче по запуску регенерации тканей через активизацию процессов восстановления организма.
Ионы, высвобождаемые из биоактивного стекла при растворении, стимулируют гены клеток к регенерации и самовосстановлению.
— Генетическая теория — Ларри Хенч
Выдвинутая теория оставалась недоказанной на практике длительное время. Доказательство теории было получено через исследование с помощью ДНК-микрочипов. Первые исследования микрочипов на биоактивных стёклах продемонстрировали их влияние на активацию генов, связанных с ростом и дифференцировкой остеобластов. Поддержка внеклеточного матрикса и стимуляция адгезии «клетка-клетка» и «клетка-матрица» были усилены кондиционированной средой для культивирования клеток, содержащей продукты растворения биоактивного стекла[16].
Исследование пяти моделей in vitro с помощью ДНК-микрочипов с использованием пяти различных источников неорганических ионов обеспечило экспериментальные доказательства генетической теории остеогенной стимуляции. Контролируемое высвобождение биологически активных ионов и из биоактивных стёкол приводит к усилению регуляции и активации семи семейств генов в остео-прогениторных клетках, которые вызывают быструю регенерацию кости. Ларри Хенч считал, что это позволит разработать новое поколение активирующих гены стёкол, предназначенное специально для тканевой инженерии и регенерации тканей на месте. Его выводы также указывают, что контролируемое высвобождение более низких концентраций ионов при растворении биоактивных стёкол может быть использовано для ангиогенеза[17].
Бесщелочные биостёкла
Несмотря на то, что композиции на основе состава 45S5 были клинически применены для более чем 1,5 миллионов пациентов, они не лишены недостатков. Из-за высокого содержания щелочей в том числе наблюдаются:
- Высокая скорость растворения, вызывающая быструю резорбцию, что может отрицательно влиять на баланс образования костной ткани, приводя к образованию зазора между костью и имплантатом;
- Плохая способность к спеканию и ранняя кристаллизация из-за узкого диапазона температур стеклования (~550°С) и начала кристаллизации (~610°С) препятствуют уплотнению и приводят к плохой механической прочности материала;
- Цитотоксический эффект, вызванный высокими дозами натрия вымываемого в культуральную среду;
- Для лечения с помощью стволовых клеток в случаях крупной реконструкции требуется использование клеточных каркасов с определённой, недоступной составу 45S5 пористостью[18].
Для устранения данных недостатков была разработана новая серия бесщелочных составов на основе диопсида , фторид-фосфата кальция и трикальцийфосфата , сочетающихся в разных пропорциях. Так, например, состав, названный 70-Di-10FA-20TCP, позволяет изготавливать «строительные леса» для костной ткани любого необходимого размера, в отличие от Bioglass 45S5.
- 70-Di-10FA-20TCP:
Кислотность и размер частиц суспензии данного материала ниже, что позволяет сократить растворение до нужных пределов. Лучшая способность к спеканию обеспечивает полное уплотнение перед началом кристаллизации и позволяет достичь лучшей механической прочности состава. Клеточные реакции in vitro показали хорошую жизнеспособность клеток и значительную стимуляцию синтеза костного матрикса, что предполагает возможное использование материала для регенерации костной ткани[18].
Рентгеноконтрастные биостёкла
Для улучшения визуализации при рентгенодиагностике применяются контрастные вещества. При работе с костной тканью с применением биоактивных стёкол классических составов улучшение визуализации результатов лучевых методов исследования затруднительно. Рентгеноконтрастные биостёкла отличаются наличием в составе дополнительных оксидов, обеспечивающих возможность применения стекла в качестве рентгеноконтрастного наполнителя для композитных материалов[19]. В качестве рентгеноконтрастного компонента в стоматологии может применяться .
Примеры:
|
|
|
Однако у таких составов низкие показатели рентгеноконтрастности. Кроме того, оксид бария токсичен и снижает химическую стойкость стекла. Одним из вариантов решения является использование оксида вольфрама вместо оксида бария и применение второго рентгеноконтрастного компонента, оксида стронция, для увеличения рентгеноконтрастности. Кроме того, увеличивает химическую стойкость и уменьшает токсичность стёкол.
Пример:
- при суммарном количестве оксида стронция и оксида вольфрама в пределах 20-30 %[20]
Составы
Базовые составы биоактивного стекла:
- 45S5:
- 58S:
- 70S30C:
- S53P4:
S53P4 является биоактивным стеклом, ингибирующим рост бактерий[21].
| Производные составы биостекла и стеклокерамики (в %) | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Марки и типы ™ |
SiO2 | P2O5 | CaO | Ca(PO3)2 | CaF2 | Na2O | MgO | K2O | Al2O3 | Ta2O5 / TiO2 | Fe2O3 | B2O3 | Отличительные свойства |
| Bioglass 42S5.6[22] | 42.1 | 2.6 | 29.0 | — | — | 26.3 | — | — | — | — | — | — | |
| Bioglass 46S5.2[22] | 46.1 | 2.6 | 26.9 | — | — | 24.4 | — | — | — | — | — | — | лучшая интеграция с тканями |
| Bioglass 49S4.9[22] | 49.1 | 2.6 | 25.3 | — | — | 23.8 | — | — | — | — | — | — | |
| Bioglass 52S4.6[22] | 52.1 | 2.6 | 23.8 | — | — | 21.5 | — | — | — | — | — | — | |
| Bioglass 55S4.3[22] | 55.1 | 2.6 | 22.2 | — | — | 20.1 | — | — | — | — | — | — | |
| Bioglass 60S3.8[22] | 60.1 | 2.6 | 19.6 | — | — | 17.7 | — | — | — | — | — | — | фосфатная плёнка не образуется |
| Bioglass 45S5[23] | 45 | 6 | 24.5 | — | — | 24.5 | — | — | — | — | — | — | оригинальный состав Bioglass; интегрируется с костями и мягкими тканями |
| Bioglass 45S5F[23] | 45 | 6 | 12.25 | — | 12.25 | 24.5 | — | — | — | — | — | — | |
| Bioglass 45S5.4F[23] | 45 | 6 | 14.7 | — | 9.8 | 24.5 | — | — | — | — | — | — | |
| Bioglass 40S5B5[23] | 40 | 6 | 24.5 | — | — | 24.5 | — | — | — | — | — | 5 | |
| Bioglass 52S4.6[23] | 52 | 6 | 21 | — | — | 21 | — | — | — | — | — | — | |
| Bioglass 55S4.3[23] | 55 | 6 | 19.5 | — | — | 19.5 | — | — | — | — | — | — | |
| Bioglass 8625 | ? | ? | ? | — | — | ? | — | — | — | — | ? | — | высокая биосовместимость, не связывается с тканями, фиброзная капсуляция; может быть отверждён лазером, используется для инкапсуляции RFID меток |
| S45PZ[24] | 45 | 7 | 22 | — | — | 24 | — | — | — | — | — | 2 | |
| Ceravital KGC[23] | 46.2 | — | 20.2 | 25.5 | — | 4.8 | 2.9 | 0.4 | — | — | — | — | |
| Ceravital KGS[23] | 46 | — | 33 | 16 | — | 5 | — | — | — | — | — | — | |
| Ceravital KGy213[23] | 38 | — | 31 | 13.5 | — | 4 | — | — | 7 | 6.5 | — | — | |
| Ceravital bioactive[22] | 40-50 | 10-15 | 30-35 | — | — | 5-10 | 2.5-5 | 0.5-3 | — | — | — | — | |
| Ceravital nonbioactive[22] | 30-35 | 7.5-12 | 25-30 | — | — | 3.5-7.5 | 1-2.5 | 0.5-2 | — | — | — | — | |
| A-W GC (Cerabone)[23] | 34.2 | 16.3 | 44.9 | — | 0.5 | — | 4.6 | — | — | — | — | — | оксифторапатит / стеклокерамический волластонит; высокая прочность, используется для замены частей костей; межфазный апатит быстро образуется; связь прочнее чем сама кость. |
| 13-93B3 (DermaFuse)[13] | — | 4 | 20 | — | — | 6 | 5 | 12 | — | — | — | 53 | эффективен для заживления повреждений и инфекций мягких тканей. |
| Bioverit[24] | 19-54 | 2-10 | 10-34 | — | 3-23 | 3-8 | 2-21 | 3-8 | 8-15 | — | — | — | биоактивная обрабатываемая стеклокерамика, содержащая апатит и флогофит, используемая в качестве искусственного позвонка[25] |
| Биоситалл М31[26] | 37.2-38.5 | 13.2-15.5 | 33.5-35.0 | — | — | — | 1.8-3.1 | — | 6.2-6.5 | — | — | — | + ZnO (4.5-5.0); заполнение костных полостей; срок резорбции 8-12 мес. |
| Ilmaplant L1[24] | 44.3 | 11.2 | 31.9 | — | 5 | 4.6 | 2.8 | 0.2 | — | — | — | — | |
Получение
Выбор формулы
Биостекло получают в различных формах: частицы, гранулы, порошок, пеллеты[27]. При изменении пропорций стеклообразующего вещества и щелочных компонентов, свойства биостекла меняются от максимальной биоактивности до биоинертности:
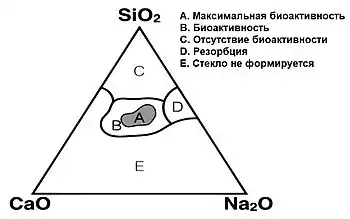 Изменение свойств биоактивного стекла |
|
Без особого влияния на образование связи биостекла с костной тканью некоторое количество можно заменить на , а некоторое количество на . Помимо этого, некоторое количество может быть заменено на , при этом изменится скорость резорбции стекла. Для облегчения обработки материала могут быть добавлены или . Однако оксид алюминия ингибирует интеграцию стекла в ткань, поэтому его объём в материале ограничивают в пределах 1-1,5 %[10].
Методы получения
Основные способы получения биоактивного стекла и его композитов — порошковый, золь-гель процесс[28][29], закалка из расплава (включая обычное охлаждение расплава), самораспространяющийся высокотемпературный синтез и микроволновое облучение[30].
Порошковый метод состоит из трех основных этапов: подготовка сырья в виде порошка, формирование заготовки прессованием, термическая обработка для повышения плотности и прочности материала. Зачастую используется горячее прессование и изостатическое прессование. В процессе штамповки происходит диффузия атомов поликристаллического материала и вязкий поток аморфного стекла[28].
Также используются химические методы, позволяющие добиться высокой молекулярной гомогенности (однородности) и чистоты продукта. Один из таких методов — превращение золя в гель, который используют для получения пенистой и пористой биоактивной стеклокерамики. Во время золь-гель процесса происходит гидролиз оксида кремния с образованием коллоидного раствора и последующая его полимеризация в реакции конденсации с образованием геля. Для высыхания и затвердевания геля не требуется такая высокая температура как при прессовании[28].
Команда Ларри Хенча получала первый состав 45S5 как методом закалки в расплаве[10], так и с помощью золь-гель процесса[31]:
- на первом этапе реагенты смешивают при комнатной температуре (гидролиз и поликонденсация происходят одновременно до гомогенизации раствора);
- 2-й этап — гелеобразование;
- термическая обработка при 60 °С для предотвращения растрескивания во время сушки (гель характеризуется уменьшением пористости, а также значительным улучшением механической прочности);
- 4-й этап — сушка для удаления жидкой фазы из пор при температуре от 120 °С до 140 °С;
- на пятом этапе высушенный гель стабилизируется при высокотемпературной термической обработке — около 700 °C[11].
Микроволновый метод заключается в том, что прекурсоры растворяют в деионизированной воде и помещают в ультразвуковую ванну для облучения. В результате облучения получают порошок, который в дальнейшем сушат и прокаливают. Данный метод занимает короткое время реакции и может применяться при создании монофазных наноразмерных порошков[30].
В 2009 году была разработана технология производства нановолокон из биостекла с использованием лазерного «прядения». Небольшое количество материала-сырья расплавляется с помощью высокоэнергетического лазера для получения сверхтонкой нити, которая затем удлиняется и охлаждается мощным газовым потоком. Преимущества технологии — скорость процесса, нановолокна образуются в течение нескольких микросекунд. Метод позволяет получать стеклянные нановолокна диаметром от десятых до сотых долей микрона. Основным недостатком лазерного «прядения» является то, что в процессе производства потребляется много энергии[32].
Свойства
Основные требования, предъявляемые к биоактивному стеклу — это соответствие заданному уровню химических, механических и биологических характеристик. Составы должны иметь заданную прочность, трещиностойкость, износостойкость и сопротивляемость усталости. При интеграции с тканями обеспечивать стимулирование остеосинтеза и биосовместимость, не должно быть реакций со стороны иммунной системы[24].
Химические свойства
Отсутствие коррозии — главное достоинство и постоянное свойство биостекла. Два основных параметра регулируются составом и методом применения материала:
- Свойство взаимодействовать с целевыми частями организма, исключая нежелательные химические реакции с тканями и межтканевыми жидкостями.
- Свойство растворяться с контролируемой скоростью, с соблюдением расчётного времени, заложенного на формирование замещаемой ткани[24].
Механическая прочность
Показатели механической прочности, в том числе усталостной, и трещиностойкости биокерамики, биостекол и биоситаллов существенно, в 10-100 раз ниже, чем у естественной костной ткани. Это ограничивает возможность использования конструкции, изготовленной из биоактивного стекла, для реконструкции органа с повреждённой костной тканью. Биостекло не как вспомогательный, а как основной материал применяется только для не несущих значительные физиологические нагрузки костей[5]. Примерами могут служить имплантация электродов для восстановления слуха при повреждении слухового нерва или восстановление корней зубов[24]. Обычно биостекло сочетается с полимерами и металлами. При определённой рецептуре и технологии производства биоактивное стекло может быть получено в виде нужной пористой структуры с заданными размерами ячеек и их ориентацией. Такие стекла могут служить наполнителем или покрытием в поглощаемых полимерах — материалах, предназначенных для постепенного распада и замены природной тканью организма-хозяина. Показатели упругости полученных композитных материалов соответствуют упругим константам кости[28].
Медленное охлаждение расплава стеклообразующих оксидов по специальным температурным режимам позволяет частично закристаллизовать стекло (при этом чаще всего образуется метасиликат кальция — волластонит ) и получить смешанные, стеклокристаллические материалы — биоситаллы, которые имеют более высокие по сравнению со стёклами механические характеристики. Термическая обработка биостекла снижает содержание летучего оксида щелочного металла и осаждает кристаллы апатита в стеклянной матрице. Полученный стеклокерамический материал имеет более высокую механическую прочность, но более низкую биологическую активность[25].
Биологическая активность
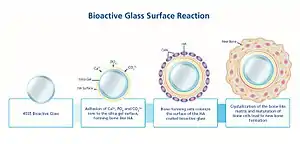
Под понятием «биологическая активность» подразумевается способность синтетического материала активно взаимодействовать с окружающими тканями с образованием непосредственной связи с ними. При использовании биологически активного материала на основе веществ, изначально близких по химическому и фазовому составу к костной ткани либо способных к образованию таких веществ на своей поверхности в результате биомиметических процессов взаимодействия с окружающими тканями и жидкостями организма, материал воспринимается организмом почти как собственная ткань[5]. Ключевым элементом, который обеспечивает высокую биоактивность биостекла, является кремний. Гидролиз биостекла в межтканевой жидкости приводит к образованию тонкого гелеобразного слоя кремниевой кислоты на поверхности имплантата. Отрицательно заряженные гидроксильные группы поверхности слоя кремнёвой кислоты притягивают из окружающего раствора межтканевой жидкости ионы , заряд поверхности становится положительным, затем на поверхность осаждаются ионы фосфорной кислоты — происходит рост слоя гидроксиапатита. В итоге переходный слой между биостеклом и костью может иметь толщину до 1 мм и быть настолько прочным, что перелом произойдёт в любом другом месте, но не в зоне срастания[34].
Биоактивное стекло образует связь с костной тканью значительно быстрее биокерамических материалов за счёт аморфности. Произвольная аморфная сетка растворяется и взаимодействует с межтканевой жидкостью значительно быстрее, чем кристаллическая решётка керамического материала. Благодаря этому гидроксиапатит формируется быстрее по сравнению с другими материалами[28].
Изменяя состав биоматериала, можно в широких пределах менять биоактивность и резорбируемость биостекла. Если материал биоактивный — образуется костная ткань, если биорезорбируемый — происходит замена материала костной тканью[24].
Применение
Биостекло на основе Bioglass 45S5 применяется в качестве малых или слабонагружаемых имплантатов в стоматологии и челюстно-лицевой хирургии. Биостекло используется в стоматологии и ортопедии для производства медицинских материалов, стимулирующих восстановление и устранение дефектов костной ткани, для формирования зубных пломб и изготовления зубных паст. Устройства, изготовленные по композитной формуле состава 45S5, называются имплантатами Bioglass. При частичной или полной кристаллизации они называются имплантатами Bioglass-Ceramic[35]. Среди наиболее успешных коммерческих продуктов отмечены биостёкла: Cortoss, Rhakoss, NovaBone[7].
Области применения
Основные источники:[36][37][38][39][40][41][42][30]
|
В хирургии
|
Области применения биоактивных стёкол продолжают расширяться[27], активно разрабатываются новые продукты для клинического применения[43].
Так как механические свойства биостёкол уступают механическим свойствам костной ткани — это не позволяет использовать их для изготовления имплантатов несущих костей. В связи с этим стёкла применяют для формирования биоактивных стеклокерамических покрытий на биоинертных подложках[44]. По той же причине, начиная с середины 90-х годов, стеклокерамические покрытия активно используются в дентальной имплантологии. Покрытия могут наноситься на поверхность любой сложности методом эмалирования, осаждения из системы «золь — гель», плазменного, радиочастотного напыления, импульсного лазерного осаждения[45] или обжигом с использованием стеклосвязки и шликерной технологии нанесения.[46].
Примеры применения биостекол

Длительное время хирурги применяли биостекло в виде порошка для устранения дефектов костей, заполняя им небольшие трещины. Начиная с 2010 года такой порошок стал главным компонентом в зубной пасте Sensodyne Repair and Protect. Это самое массовое применение биоактивного материала[15].
Bioglass 8625 представляет собой натриево-известковое стекло, используемое для герметизации имплантатов. Материал имеет значительное содержание железа, которое благодаря свойству поглощения инфракрасного излучения позволяет материалу полимеризоваться под источником света. Наиболее распространённое использование Bioglass 8625 — в корпусах RFID-транспондеров при чипировании человека и животных[41]. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило применение Bioglass 8625 на людях в 1994 году, уже через четыре года после выдачи сертификата на применение для чипирования животных[47].
Dermafuse — биостекло на основе 13-93B3 — используется в медицине и ветеринарии. Состав работает в форме салфеток из нановолокон для продолжительного лечения ран мягких тканей. Клей на его основе применяется для быстрой обработки незначительных ран. При контакте с тканями клей переходит из жидкого в твёрдое состояние, полимеризуясь в течение нескольких секунд и герметизируя рану[40].
Биостекло Biogran — остеокондуктивный материал, применяемый для лечения пародонтальных дефектов. Размер биоактивных гранул находится в пределах 300—355 мкм, они полностью рассасываются в организме и распадаются в результате цикла Кребса. Костная ткань прорастает от гранулы к грануле, быстро заполняя дефект костной тканью. Полное замещение новой костью происходит в течение 9-12 месяцев[48].
См. также
Примечания
- Медков М. А., Грищенко Д. Н. Патент RU 2 690 854 C1 «Способ получения борсодержащего биоактивного стекла». Федеральное государственное бюджетное учреждение науки Институт химии Дальневосточного отделения Российской академии наук (6 июня 2019).
- Hench, L.L. The story of Bioglass (англ.) // Journal of Materials Science in Medicine. — 2006. — December (vol. 17, no. 11). — P. 967—978. — doi:10.1007/s10856-006-0432-z. — PMID 17122907.
- Marina N. Richard. Bioactive behavior of a borate glass : [англ.] // Missouri University of Science and Technology. — 2000. — March. — P. 140. — Electronic OCLC # 906031023.
- Искусственная хрящевая ткань из биостекла. ENG News - Новости инженерии (13 мая 2016). Дата обращения: 31 июля 2019.
- С.М. Баринов, В.С. Комлев. Биокерамика на основе фосфатов кальция : [рус.]. — РАН Институт физико-химических проблем керамических материалов. — М. : Наука, 2005. — ISBN 5-02-033724-2.
- Марк Медовник. Из чего это сделано? Удивительные материалы, из которых построена современная цивилизация. — Litres, 2019. — ISBN 504011754X, 9785040117543.
- Бартов М.С. Диссертация "Новые биотехнологические подходы к созданию остеоиндуктивных материалов на основе белка rhBMP-2, полученного микробиологическим синтезом в escherichia coli". ФГБУ Федеральный Научно-Исследовательский Центр Эпидемиологии и Микробиологии Имени Почётного Академика Н.Ф. Гамалеи (2015). Дата обращения: 30 июля 2019.
- About the Society (англ.). The Society For Biomaterials. Дата обращения: 31 июля 2019.
- Нistory of ESB (англ.). European Society for Biomaterials. Дата обращения: 24 августа 2019.
- Bekir KARASU, Ali Ozan YANAR, Alper KOÇAK, Özden KISACIK. Bioactive Glasses : [англ.] // El-Cezerî Journal of Science and Engineering. — 2017. — № 3 (15 July). — С. 436—471. — ISSN 2148-3736.
- Elisa Fiume, Jacopo Barberi, Enrica Verné and Francesco Baino. Bioactive Glasses: From Parent 45S5 Composition to Scaffold-Assisted Tissue-Healing Therapies // Journal of Functional Biomaterials. — 2018. — № 24 (16 марта). — doi:10.3390/jfb9010024.
- Mona A. Ouis, Amr M. Abdelghany, Hatem A. ElBatal. Sintering Behavior and Property of Bioglass Modified HA-Al2O3Composite // Science of Sintering. — 2012. — Вып. 44. — С. 141—149. — doi:10.2298/SOS1203265W.
- Создан материал из нановолокон, эффективно заживляющий раны. Nano News Net (16 мая 2011). Дата обращения: 31 июля 2019.
- Mo-Sci Corporation’s DermaFuse: Successful wound healing with borate glass nanofibers (англ.). The American Ceramic Society (28 апреля 2011). Дата обращения: 31 июля 2019.
- Дэвид Кокс. Медицина будущего: как биостекло совершит революцию в хирургии. BBC Future (7 августа 2017). Дата обращения: 31 июля 2019.
- Subrata Pal. Design of Artificial Human Joints & Organs. — Springer Science & Business Media, 2013. — С. 68. — 419 с. — ISBN 146146255X, 9781461462552.
- Larry L.Hench. Genetic design of bioactive glass (англ.). ScienceDirect ®. Journal of the European Ceramic Society // Volume 29 (7 апреля 2009). doi:S095522190800441X. Дата обращения: 4 августа 2019.
- José M F Ferreira, Avito Rebelo. The key Features expected from a Perfect Bioactive Glass – How Far we still are from an Ideal Composition? : [англ.] // Biomedical Journal of Scientific & Technical Research. — 2017. — 7 September. — ISSN 2574-1241. — doi:10.26717/BJSTR.2017.01.000335.
- Медков М. А., Грищенко Д. Н., Курявый В. Г., Слободюк А. Б. Вольфрам-содержащие рентгеноконтрастные биоактивные стекла: получение и свойства = ФГБОУН «Институт химии ДВО РАН» // Стекло и Керамика. — 2018. — № 8 (август). — С. 40—45. — ISSN 0131-9582.
- Пелеш А.М., Изобелло Ю.Н., Аняйкина Н.П., Жигар В.В., Изобелло Н.М., Мялик О.А. Рентгеноконтрастное стекло, Патент BY 13965 C1 2011/02/28. База патентов Беларуси (28 февраля 2011). Дата обращения: 7 августа 2019.
- Mateus Trinconi Cunha, Maria Aparecida Murça, Stanley Nigro, Giselle Burlamaqui Klautau, Mauro José Costa. In vitro antibacterial activity of bioactive glass S53P4 on multiresistant pathogens causing osteomyelitis and prosthetic joint infection : [англ.] // BMC Infectious Diseases. — 2018. — № 18 (3 April). — doi:10.1186/s12879-018-3069-x.
- The biomedical engineering handbook, Volume 1 by Joseph D. Bronzino, Springer, 2000 ISBN 3-540-66351-7
- Biomaterials and tissue engineering by Donglu Shi p. 27, Springer, 2004 ISBN 3-540-22203-0
- Перспективные неорганические материалы со специальными функциями. - Применение биостеклокерамики - курс лекций. Химический факультет МГУ. Дата обращения: 31 июля 2019.
- Engineering materials for biomedical applications by Swee Hin Teoh, p.6-21, World Scientific, 2004 ISBN 9812560610
- Афиногенов Г.Е. Иванцова, Т.М. Лысенок, Л.Н. Патент RU 2 103 013 C1 "Композиция для заполнения костных полостей". РНИИТО им. Р.Р. Вредена (27 января 1998). Дата обращения: 5 августа 2019.
- Vidya Krishnan, T. Lakshmi. Bioglass: A novel biocompatible innovation // Journal of Advanced Pharmaceutical Technology & Research. — 2013. — № 4. — С. 78—83. — doi:10.4103/2231-4040.111523.
- Лэрри Хенч, Джулиан Джонс. Биоматериалы, искусственные органы и инжиниринг тканей / А. Лушникова. — Litres, 2017. — ISBN 5457371395, 9785457371392.
- С.Ф. Забелин, Ж.Ю.Коновалова. Анализ технологий получения биокерамики для имплантатов // Ученые записки ЗабГУ. — 2016. — Т. 11, № 4 (15 апреля). — С. 85—90. — doi:10.21209/2308-8761-2016-11-4-85-90.
- Yaser Dahman. Biomaterials Science and Technology: Fundamentals and Developments. — CRC Press, 2019. — 258 с. — ISBN 0429878346, 9780429878343.
- Larry L. Hench, Jon K. West. The sol-gel process // Chemical Reviews. — 1990. — № 1 (1 января). — С. 33—72. — doi:10.1021/cr00099a003.
- Sabu Thomas, Preetha Balakrishnan, M.S. Sreekala. Fundamental Biomaterials: Ceramics. — Woodhead Publishing Series in Biomaterials. — Woodhead Publishing, 2018. — P. 498. — ISBN 0081022042, 9780081022047.
- Takamasa Onoki. Porous apatite coating on various titanium metallic materials via low temperature processing : [англ.] // Biomaterials Science and Engineering, IntechOpen. — 2011. — 15 September. — doi:10.5772/24624.
- В.И. Путляев. Современные керамические материалы : Московский государственный университет им. М.В. Ломоносова // Соросовский образовательный журнал. — 2004. — Т. 8, № 1. — С. 46.
- L. Hench, June Wilson, G. Merwin. Bioglass™ Implants for Otology. Материалы Первого Международного симпозиума "Биоматериалы в Отологии", Лейден, Нидерланды (21 апреля 1983). Дата обращения: 31 июля 2019.
- Дубок В.А., Гайко Г.В., Бруско А.Т., Киндрат В.В., Шинкарук А.В. Современные неорганические биоматериалы для пластики кости – пути и результаты усовершенствования // ВІСНИК Української медичної стоматологічної академії. — Т. 7, № 1—2. — С. 271—280.
- Сборник материалов Всероссийской молодежной научной конференции. Актуальные вопросы биомедицинской инженерии // Саратовский государственный технический университет имени Гагарина Ю.А. — 2013. — 20 мая. — ISSN 978-5-9758-1489-0.
- Гречуха А. М. Применение биоактивного стеклокристаллического материала "Биоситалл-11" для замещения костных дефектов лицевого скелета (экспериментально-клиническое исследование) // ФГУ "Центральный научно-исследовательский институт стоматологии". — 2009.
- Керамические и стеклокристаллические материалы для медицины. studwood.ru. Дата обращения: 25 сентября 2019.
- Dermafuse™ Tissue Adhesive 3g (англ.). Millpledge Pharmaceuticals. Дата обращения: 24 августа 2019.
- RFID Transponder Glass Capsules (англ.). SCHOTT AG. Дата обращения: 30 июля 2019.
- Костный материал для синус-лифтинга: обзор литературы. Конектбиофарм «Останови резорбцию». Дата обращения: 2 октября 2019.
- Ю. Инина. Заманчивое биостекло. Оно может совершить революцию в хирургии // Медицинская газета (Дайджест). — 2017. — № 63 (25 августа). — С. 15.
- М.А. Медков, Д.Н. Грищенко. Получение биоактивных материалов медицинского назначения // Институт химии Дальневосточного отделения РАН. — 2015. — С. 409.
- А.В.Юмашев, А.С.Утюж, А.О.Зекий. Наноразмерные покрытия в дентальной импланталогии. Инновационный Центр Развития Образования и Науки (11 октября 2017). Дата обращения: 29 сентября 2019.
- Т.С.Петровская. Физико-химические основы и технологии получения биосовместимых покрытий на титановых имплантатах и регулирование их биологических свойств // ФГБОУ ВПО «Национального исследовательского Томского политехнического университета». — 2013. — 12 апреля.
- Ministry for Primary Industries. Food safety risk assessment for the use of PIT tags in the SNA 1 tagging programme : [англ.] // New Zealand Fisheries Assessment Report. — 2018. — № 2 (January). — ISSN 1179-5352.
- Biomet, Inc. Biogran ® - Резорбируемый синтетический материал. Дата обращения: 24 августа 2019.

