Аксонный холмик
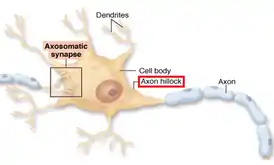
Аксонный холмик — специализированная часть тела (перикариона) клетки Нейрона, которая связывается с аксоном. Аксонный холмик различим в световом микроскопе по своему виду и локализации в нейроне и по распределению вещества Ниссля[1].
| Аксонный холмик | |
|---|---|
| лат. Colliculus axonis | |
 | |
| Система | Нервная система |
Аксонный холмик представляет собой последний сегмент перикариона, в котором мембранный потенциал от синапсов суммируется перед передачей в аксон[2]. Считалось, что аксонный холмик является участком инициации потенциала действия — триггерной зоной. В настоящее время наиболее ранним участком инициации потенциала действия является начальный сегмент: участок между оконечностью аксонного холмика и начальным немиелинизированным сегментом аксона[3].
Структура
Аксонный холмик и начальный сегмент характеризуются особенностями, которые позволяют им генерировать потенциал действия, включая наличие расположенного рядом с ними аксона и гораздо более высокую плотность потенциал-управляемых ионных каналов, чем на остальном теле нейрона[4]. В клетках спинального ганглия клеточная мембрана тела нейрона содержит около 1 потенциал-управляемого ионного канала на мкм2, в то время как аксонный холмик и начальный сегмент аксона содержит около 100—200, а аксон — около 1-2 тыс. ионных каналов на мкм2[5]. Такая кластеризация потенциал-управляемых ионных каналов опосредуется белками, связанными с мембраной и цитоскелетом, такими как анкирины[6].
Функции
Как тормозной (IPSP), так и возбуждающий (EPSP) постсинаптические потенциалы накапливаются в аксонном холмике и после преодоления порога потенциал действия распространяется по аксону (а также в обратном направлении к дендритам). Запуск осуществляется за счёт механизма положительной обратной связи между потенциал-зависимыми ионными каналами, которые находятся с критической плотностью на аксонном холмике (а также в перехватах Ранвье), но не на основном теле нейрона.
В состоянии покоя нейрон поляризован и имеет внутренний потенциал −70 mV по отношению к окружающей среде. Когда возбуждающий нейромедиатор высвобождается пресинатическим нейроном и связывается с постсинаптическим дендритным шипиком, лиганд-зависимые ионные каналы открываются, что позволяет ионам натрия входить в клетку. Это деполяризует постсинаптическую мембрану, то есть делает её менее отрицательной. Деполяризация проходит по направлению к аксонному холмику, экспоненциально снижаясь со временем и расстоянием. Если несколько таких процессов происходит в течение короткого времени, аксонный холмик может стать достаточно деполяризован для того, чтобы открылись потенциал-зависимые натриевые каналы. Это инициирует потенциал действия, который распространяется по аксону.
Когда ионы натрия входят в клетку, потенциал клеточной мембраны становится более положительным, что активизирует натриевые каналы на мембране. В конечном итоге вход натрия превосходит выход калия, запуская положительную обратную связь (фаза нарастания). При мембранном потенциале +40 mV потенциал-зависимые натриевые каналы закрываются (пик), а потенциал-зависимые калиевые каналы начинают открываться и переносят ионы калия вдоль его электрохимического градиента из клетки (фаза реполяризации).
Калиевые каналы действуют с задержкой по отношению к реполяризации мембраны и остаются активными даже после того, как потенциал покоя достигнут, в результате чего калий продолжает выходить из клетки и потенциал становится несколько более отрицательным, чем потенциал покоя. Такой следовой потенциал предотвращает возможность распространения потенциала действия по аксону в обратном направлении.
После инициации потенциала действия в основном в аксонном холмике он распространяется по аксону. В обычных условиях такой потенциал мог бы быстро снизиться из-за пористости клеточной мембраны. Для предотвращения потери потенциала действия аксон миелинизирован. Производное холестерина миелин действует как изолирующая оболочка, благодаря чему сигнал не теряется через ионные каналы. Кроме этого, между миелиновыми оболочками существуют разрывы — перехваты Ранвье — которые способны усиливать силу сигнала. Когда потенциал действия достигает перехвата Ранвье, он деполяризует клеточную мембрану. При деполяризации мембраны потенциал-зависимые натриевые каналы, которыми исключительно богаты эти участки, открываются и запускают новый потенциал действия.
Примечания
- Palay, Sanford L.; Sotelo, Constantino; Peters, Alan; Orkand, Paula M. (1968). “The Axon Hillock and the Initial Segment”. The Journal of Cell Biology. 38 (1): 193—201. DOI:10.1083/jcb.38.1.193. PMC 2107452. PMID 5691973.
- Hemmings, Hugh C. Pharmacology and Physiology for Anesthesia E-Book: Foundations and Clinical Application : [англ.] / Hugh C. Hemmings, Talmage D. Egan. — Elsevier Health Sciences, 2012-12-06. — ISBN 9781455737932.
- Clark BD, Goldberg EM, Rudy B (December 2009). “Electrogenic Tuning of the Axon Initial Segment”. Neuroscientist. 15 (6): 651—668. DOI:10.1177/1073858409341973. PMC 2951114. PMID 20007821.
- Wollner D, Catterall WA (November 1986). “Localization of sodium channels in axon hillocks and initial segments of retinal ganglion cells”. Proceedings of the National Academy of Sciences of the United States of America. 83 (21): 8424—28. Bibcode:1986PNAS...83.8424W. DOI:10.1073/pnas.83.21.8424. PMC 386941. PMID 2430289.
- Safronov BV, Wolff M, Vogel W (February 1, 1999). “Axonal expression of sodium channels in rat spinal neurones during postnatal development”. J. Physiol. 514 (3): 729—34. DOI:10.1111/j.1469-7793.1999.729ad.x. PMC 2269106. PMID 9882745.
- Zhou D, Lambert S, Malen PL, Carpenter S, Boland LM, Bennett V (November 30, 1998). “AnkyrinG Is Required for Clustering of Voltage-gated Na Channels at Axon Initial Segments and for Normal Action Potential Firing”. The Journal of Cell Biology. 143 (5): 1295—304. DOI:10.1083/jcb.143.5.1295. PMC 2133082. PMID 9832557.