Акрозин
Акрозин (Шифр КФ 3.4.21.10) — фермент, сериновая протеаза, продукт гена человека ACR[1][2]. Акрозин высвобождается из акросомы сперматозоида в результате акросомной реакции и участвует в проникновении через Zona pellucida яйцеклетки.
| Акрозин | |
|---|---|
 | |
| Идентификаторы | |
| Шифр КФ | 3.4.21.10 |
| Номер CAS | 9068-57-9 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9068-57-9 |
Ферментативный механизм
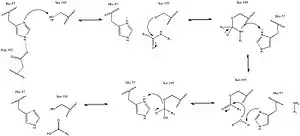
Акрозин является типичной сериновой протеазой с трипсино-подобной специфичностью[3].
Каталитическая реакция проходит по классической для сериновых протеаз схеме. Сначала гистидин-57 депротонирует серин-195, позволяя последнему действовать в качестве нуклеофила. Депротонированный серин-195 реагирует с углеродом карбонильной группы пептида, формируя промежуточный тетраэдральный комплекс. Затем комплекс распадается с уходом группы H2N-R1, которая протонируется гистидином-57. Гистидин-57 депротонирует молекулу воды, служащую в результате нуклеофилом в реакции с углеродом карбонильной группы. С другой стороны, распад промежуточного тетраэдрального комплекса также приводит к уходу серина-195, протонируемого гистидином-57. В результате все аминокислотные остатки акрозина возвращаются в исходное состояние с образованием карбоксильной группы в положении пептидной связи субстрата.
Биологические функции
Акрозин является основной протеазой, присутствующей в акросоме сперматозоида. Он хранится в акросоме в виде неактивного предшественника, про-акрозина. В результате стимуляции акросома выделяет своё содержимое на поверхность zona pellucida. После этого зимогенная форма протеазы переходит в активную форму β-акрозин. Активный фермент участвует в лизисе zona pellucida, что облегчает проникновение спермы через внутренние гликопротеиновые слои оболочки яйцеклкетки[3].
Однако важность акрозина в проникновении сперматозоида через zona pellucida неясна, так как было показано, что сперматозоиды мыши, в которых активный β-акрозин отсутствовал, всё ещё обладали способностью проникать через zona pellucida[4]. Были предположения, что акрозин, возможно, участвует в распространении содержимого акросомы после акросомной реакции или служит вторичным связывающим белком между сперматозоидом и zona pellucida[5][6][7].
Регуляция акрозина осуществляется ингибитором протеина C SERPINA5. Концентрация белка SERPINA5 в мужской половой системе в 40 раз превышает таковую в крови[8]. SERPINA5 ингибирует протеолитическую активность акрозина[8] и, возможно, играет защитную роль в случае преждевременного высвобождения фермента или при дегенерации сперматозоидов в организме для предотвращения повреждения окружающих тканей[9].
В патологии
Хотя в исследованиях на мышах было показано, что акрозин не является ключевым компонентом для проникновения сперматозоидов через оболочку яйцеклетки, у человека существует корреляция между акросомальной протеазной активностью и мужским бесплодием[10][11]. Также обнаружена сильная корреляция между активностью акрозина и подвижностью спермы[12].
Примечания
- Adham IM, Klemm U, Maier WM, Engel W (Jan 1990). “Molecular cloning of human preproacrosin cDNA”. Human Genetics. 84 (2): 125—8. DOI:10.1007/bf00208925. PMID 2298447.
- Honda A, Siruntawineti J, Baba T (2002). “Role of acrosomal matrix proteases in sperm-zona pellucida interactions”. Human Reproduction Update. 8 (5): 405—12. DOI:10.1093/humupd/8.5.405. PMID 12398221.
- Tranter, Rebecca; Read, Jon A.; Jones, Roy; Brady, R. Leo (2000-11-15). “Effector Sites in the Three-Dimensional Structure of Mammalian Sperm β-Acrosin”. Structure [англ.]. 8 (11): 1179—1188. DOI:10.1016/S0969-2126(00)00523-2. ISSN 0969-2126. PMID 11080640.
- Baba T, Azuma S, Kashiwabara S, Toyoda Y (1994). “Sperm from mice carrying a targeted mutation of the acrosin gene can penetrate the oocyte zona pellucida and effect fertilization”. J Biol Chem. 269 (50): 31845—9. PMID 7989357.
- Yamagata K, Murayama K, Okabe M, Toshimori K, Nakanishi T, Kashiwabara S; et al. (1998). “Acrosin accelerates the dispersal of sperm acrosomal proteins during acrosome reaction”. J Biol Chem. 273 (17): 10470—4. DOI:10.1074/jbc.273.17.10470. PMID 9553106.
- Jones R, Brown CR (1987). “Identification of a zona-binding protein from boar spermatozoa as proacrosin”. Exp Cell Res. 171 (2): 503—8. DOI:10.1016/0014-4827(87)90182-0. PMID 3113989.
- Jones R (1991). “Interaction of zona pellucida glycoproteins, sulphated carbohydrates and synthetic polymers with proacrosin, the putative egg-binding protein from mammalian spermatozoa”. Development. 111 (4): 1155—63. PMID 1652426.
- Laurell, M; Christensson, A; Abrahamsson, PA; Stenflo, J; Lilja, H (1992). “Protein C inhibitor in human body fluids. Seminal plasma is rich in inhibitor antigen deriving from cells throughout the male reproductive system”. J Clin Invest. 89 (4): 1094—101. DOI:10.1172/JCI115689. PMC 442965. PMID 1372913.
- Zheng, X; Geiger, M; Ecke, S (1994). “Inhibition of acrosin by protein C inhibitor and localization of protein C inhibitor to spermatozoa”. Am. J. Physiol. 267 (2 Pt 1): C466—72. DOI:10.1152/ajpcell.1994.267.2.C466. PMID 7521127.
- Welker B, Bernstein GS, Diedrich K, Nakamura RM, Krebs D (Oct 1988). “Acrosomal proteinase activity of human spermatozoa and relation of results to semen quality”. Hum Reprod. 3 (Suppl 2): 75—80. DOI:10.1093/humrep/3.suppl_2.75.
- Tummon I.S.; Yuzpe A.A.; Daniel S.A.; Deutsch A. Total acrosin activity correlates with fertility potential after fertilization in vitro" Fertil Steril 1991 Nov;56(5):933-8.
- Cui YH, Zhao RL, Wang Q, Zhang ZY (Sep 2000). “Determination of sperm acrosin activity for evaluation of male fertility”. Asian J Androl. 2: 229—232.
Литература
- Elce JS, McIntyre EJ (Jan 1982). “Purification of bovine and human acrosin”. Canadian Journal of Biochemistry. 60 (1): 8—14. DOI:10.1139/o82-002. PMID 6802470.
- Kimura K, Wakamatsu A, Suzuki Y, Ota T, Nishikawa T, Yamashita R, Yamamoto J, Sekine M, Tsuritani K, Wakaguri H, Ishii S, Sugiyama T, Saito K, Isono Y, Irie R, Kushida N, Yoneyama T, Otsuka R, Kanda K, Yokoi T, Kondo H, Wagatsuma M, Murakawa K, Ishida S, Ishibashi T, Takahashi-Fujii A, Tanase T, Nagai K, Kikuchi H, Nakai K, Isogai T, Sugano S (Jan 2006). “Diversification of transcriptional modulation: large-scale identification and characterization of putative alternative promoters of human genes”. Genome Research. 16 (1): 55—65. DOI:10.1101/gr.4039406. PMC 1356129. PMID 16344560.
- Klemm U, Müller-Esterl W, Engel W (Oct 1991). “Acrosin, the peculiar sperm-specific serine protease”. Human Genetics. 87 (6): 635—41. DOI:10.1007/bf00201716. PMID 1937464.
- Kim J, Bhinge AA, Morgan XC, Iyer VR (Jan 2005). “Mapping DNA-protein interactions in large genomes by sequence tag analysis of genomic enrichment”. Nature Methods. 2 (1): 47—53. DOI:10.1038/nmeth726. PMID 15782160.
- Moreno RD, Hoshi M, Barros C (May 1999). “Functional interactions between sulphated polysaccharides and proacrosin: implications in sperm binding and digestion of zona pellucida”. Zygote. 7 (2): 105—11. DOI:10.1017/S0967199499000453. PMID 10418103.
- Liu RZ, Lu YL, Xu ZG, Zuo WJ, Xin JL, Wang ZS (2003). “[The effect of semen antisperm antibody on human sperm acrosin activity]”. Zhonghua Nan Ke Xue = National Journal of Andrology. 9 (4): 252—3. PMID 12931362.
- Steven FS, Griffin MM, Chantler EN (Aug 1982). “Inhibition of human and bovine sperm acrosin by divalent metal ions. Possible role of zinc as a regulator of acrosin activity”. International Journal of Andrology. 5 (4): 401—12. DOI:10.1111/j.1365-2605.1982.tb00270.x. PMID 6815104.
- Marí SI, Rawe V, Biancotti JC, Charreau EH, Dain L, Vazquez-Levin MH (Jun 2003). “Biochemical and molecular studies of the proacrosin/acrosin system in patients with unexplained infertility”. Fertility and Sterility. 79 Suppl 3: 1676—9. DOI:10.1016/s0015-0282(03)00372-8. PMID 12801583.
- Glogowski J, Demianowicz W, Piros B, Ciereszko A (Oct 1998). “Determination of acrosin activity of boar spermatozoa by the clinical method: optimization of the assay and changes during short-term storage of semen”. Theriogenology. 50 (6): 861—72. DOI:10.1016/S0093-691X(98)00191-5. PMID 10734459.
- Furlong LI, Veaute C, Vazquez-Levin MH (Jun 2005). “Binding of recombinant human proacrosin/acrosin to zona pellucida glycoproteins. II. Participation of mannose residues in the interaction”. Fertility and Sterility. 83 (6): 1791—6. DOI:10.1016/j.fertnstert.2004.12.043. PMID 15950652.
- Furlong LI, Harris JD, Vazquez-Levin MH (Jun 2005). “Binding of recombinant human proacrosin/acrosin to zona pellucida (ZP) glycoproteins. I. Studies with recombinant human ZPA, ZPB, and ZPC”. Fertility and Sterility. 83 (6): 1780—90. DOI:10.1016/j.fertnstert.2004.12.042. PMID 15950651.
- Hartley JL, Temple GF, Brasch MA (Nov 2000). “DNA cloning using in vitro site-specific recombination”. Genome Research. 10 (11): 1788—95. DOI:10.1101/gr.143000. PMC 310948. PMID 11076863.
- Collins JE, Wright CL, Edwards CA, Davis MP, Grinham JA, Cole CG, Goward ME, Aguado B, Mallya M, Mokrab Y, Huckle EJ, Beare DM, Dunham I (2004). “A genome annotation-driven approach to cloning the human ORFeome”. Genome Biology. 5 (10): R84. DOI:10.1186/gb-2004-5-10-r84. PMC 545604. PMID 15461802.
- Dubé C, Leclerc P, Baba T, Reyes-Moreno C, Bailey JL (2005). “The proacrosin binding protein, sp32, is tyrosine phosphorylated during capacitation of pig sperm”. Journal of Andrology. 26 (4): 519—28. DOI:10.2164/jandrol.04163. PMID 15955892.
- Zahn A, Furlong LI, Biancotti JC, Ghiringhelli PD, Marijn-Briggiler CI, Vazquez-Levin MH (Mar 2002). “Evaluation of the proacrosin/acrosin system and its mechanism of activation in human sperm extracts”. Journal of Reproductive Immunology. 54 (1—2): 43—63. DOI:10.1016/S0165-0378(01)00080-8. PMID 11839395.
- Howes E, Pascall JC, Engel W, Jones R (Nov 2001). “Interactions between mouse ZP2 glycoprotein and proacrosin; a mechanism for secondary binding of sperm to the zona pellucida during fertilization”. Journal of Cell Science. 114 (Pt 22): 4127—36. PMID 11739644.
- Yudin AI, Vandevoort CA, Li MW, Overstreet JW (Jul 1999). “PH-20 but not acrosin is involved in sperm penetration of the macaque zona pellucida”. Molecular Reproduction and Development. 53 (3): 350—62. DOI:10.1002/(SICI)1098-2795(199907)53:3<350::AID-MRD11>3.0.CO;2-9. PMID 10369396.
