Фотометрическое титрование
Фотометрическое титрование — группа методов объёмного (титриметрического) анализа, в которых конечная точка титрования определяется по изменению оптической плотности раствора в ходе химической реакции между титрантом и титруемым веществом[1].
.png.webp)
Фотометрическое титрование, как правило, обеспечивает более точные результаты, чем прямой фотометрический анализ. Группа методов широко используется, так как явление поглощения квантов электромагнитного излучения в ультрафиолетовой или видимой области спектра свойственно многим неорганическим и органическим веществам различной химической природы.
Измерение
Графическим отображением изменений является построенная по экспериментальным данным кривая титрования, имеющая сингулярную точку — как правило, излом на кривой. Принимая этот излом за конечную точку титрования, находят расход титранта и по формулам выполняют расчёты результатов определения. Величиной, измеряемой в процессе титрования, является оптическая плотность анализируемого раствора А[1]:
где I0, I — интенсивность света соответственно до и после прохождения им кюветы с фотометрируемым раствором.
Значения А можно измерять, используя поток высокой степени монохроматичности, то есть с определённой длиной волны в случае применения спектрофотометра, или с длинами волн, лежащими в некотором интервале, при работе с фотометром и фотоэлектроколориметром, когда монохроматизация осуществляется с помощью светофильтров. Первый вариант титрования в аналитической химии принято называть спектрофотометрическим, а второй — фотометрическим[1].
По полученным данным строят зависимость А от V (объем титранта), и по положению точки излома или перегиба находят точку эквивалентности. Точность установления точки эквивалентности тем больше, чем резче выражен излом на кривой вблизи этой точки. Если на кривых спектрофотометрического титрования отсутствует резкий излом, но имеет место плавное изменение оптической плотности (реакция не доходит до конца, продукт реакции малоустойчив), то точку эквивалентности находят, экстраполируя касательные к участкам кривой титрования[2].
Аппаратура

Первый опыт использования фотоэлектрического фотометра для титрования был осуществлен в 1928 году Мюллером и Патриджем. Они применили фотоэлемент с внешним фотоэффектом, потенциал которого усиливался триодом, управляющим реле, которое регулирует магнитное устройство для закрывания крана бюретки. Освещение фотоэлемента осуществлялось излучением лампы накаливания, проходящим через стакан для титрования. Позже Элайа предложил более простой прибор: он использовал фотоэлемент с запирающим слоем и светофильтром, расположенным под стаканом для титрования, а над ним была подвешена лампа накаливания с рефлектором[3].
Вообще, для титрования можно применять почти любой тип фотометра, заменяя обычные кюветы специальным сосудом для титрования. В современной химии, как правило, титрование проводят в кюветах в спектрофотометрах, снабженных специальными кюветными крышками с отверстиями для ввода кончика полумикробюретки и мешалки[2]. Роль параметрического стабилизатора источника излучения в видимой области выполняет лампа накаливания, в ультрафиолетовой области — водородная или дейтериевая лампа. Используются стандартные кюветы с толщиной поглощающего слоя от 2 до 5 см (в видимой области) и кварцевые или стеклянные кюветы (в УФ-области). Для дозирования рабочего раствора используют бюретки, в том числе и полуавтоматические[1].
Существуют также и автоматические и полуавтоматические титраторы. В одних приборах может быть функция регистрации результатов анализа на самописце, в других в конечной точке титрования с помощью электрического устройства может автоматически закрываться кран бюретки. В современной аппаратуре предусмотрено компьютерное управление[4].
Классификация
Различают два варианта фотометрического титрования[5]:
- титрование без индикатора;
- титрование с индикатором.
Титрование без индикатора (по собственному поглощению) может быть осуществлено в том случае, если хотя бы один из компонентов (определяемое вещество А, титрант В или продукт реакции С) поглощает излучение в выбранной рабочей оптической области. В этом случае кривые титрования прямолинейны, и за конечную точку принимается точка излома. Если компоненты аналитической реакции не обладают собственным поглощением или оно очень мало, то используют индикатор. В титруемый раствор перед титрованием вводятся индикатор, который образует окрашенное соединение с определяемым веществом[6]
или с избытком титранта[6]
В результате протекания реакции в момент эквивалентности наблюдается резкое уменьшение концентрации определяемого вещества или резкое уменьшение концентрации титранта, и в растворе протекают реакции, которые вызывают изменение состояния индикатора и, как следствие, поглощение титруемого раствора[6]:

При этом кривые титрования нелинейны, и за конечную точку принимают точку перегиба[6].
Так, при титровании Fe3+ применяется салициловая кислота, которая образует окрашенное соединение с ионами железа, максимум поглощения которого находится на длине волны 525 нм. При титровании этого раствора ЭДТА наблюдается уменьшение поглощения. Роль индикаторов также выполняют вещества, меняющие свою структуру в точке эквивалентности за счет изменения кислотности, окислительно-восстановильного потенциала системы или концентрации ионов. Это сопровождается резким изменением светопоглощения раствора[7].
Кривые титрования
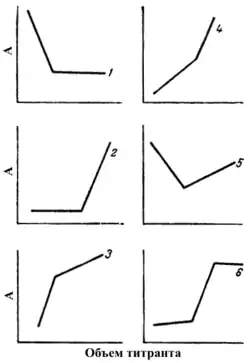
Кривые спектрофотометрического титрования могут быть различной формы, характер которых зависит от того, какие компоненты реакции поглощают при выбранной длине волны[7].
- Анализируемое вещество (А) при данной длине волны поглощает, титрант (В) и продукт реакции (C) — не поглощают. При уменьшении концентрации определяемого вещества оптическая плотность также уменьшается и после точки эквивалентности остаётся неизменной (кривая 1 на рисунке справа). Данная кривая наблюдается при титровании бихромат-ионов солями железа (II) или мышьяка (III).
- Продукт реакции (C) — поглощает, анализируемое вещество (А) и титрант (В) — не поглощают. По мере образования продукта реакции оптическая плотность увеличивается. и после точки эквивалентности остаётся неизменной (кривая имеет ход, обратный ходу кривой 1). Данная кривая наблюдается при титровании соединений железа (II) соединениями кобальта (III).
- Анализируемое вещество (А) и продукт реакции (C) — не поглощают, титрант (В) — поглощает. До точки эквивалентности оптическая плотность остаётся постоянной, а после неё начинает увеличивается по мере накопления в растворе избытка титранта (кривая 2). Данная кривая наблюдается при титровании соединений мышьяка (III) солями церия (IV).
- Продукт реакции (C) и титрант (В) — поглощает, анализируемое вещество (А) — не поглощает. Данная кривая титрования зависит от того, что поглощает в большей степени: продукт реакции или титрант.
- Если продукт реакции поглощает больше, чем титрант, то оптическая плотность увеличивается по мере накопления продукта реакции, а после точки эквивалентности возрастает по мере накопления титранта (кривая 3).
- Если титрант поглощает больше, то оптическая плотность увеличивается по мере накопления окрашенного продукта реакции, а после точки эквивалентности происходит более резкое возрастание светопоглощения по мере накопления титранта (кривая 4).
- Анализируемое вещество (А) и титрант (В) — поглощает, продукт реакции (C) — не поглощает. При уменьшении анализируемого вещества оптическая плотность также уменьшается и после точки эквивалентности светопоглощения увеличивается по мере накопления избытка титранта (кривая 5).
- Поглощают все три компонента: анализируемый продукт (А), титрант (В) и продукт реакции (C). Светопоглощение раствора после достижения точки эквивалентности определяется избытком титранта.
При раздельном титровании смеси кривая титрования будет иметь несколько изломов, число которых будет соответствует числу компонентов анализируемой смеси[7].
Факторы, влияющие на точность результатов

Основными факторами, влияющими на воспроизводимость и правильность фотометрического титрования являются[5]:
- погрешность разбавления;
- характеристики рабочих ячеек;
- выбор рабочей длины волны.
Необходимость учёта погрешности разбавления возникает в случае, если к титруемому раствору было добавлено относительно большое количество титранта. Если данной поправкой пренебречь, то в случае с кривыми титрования, аналогичными кривой 2, получается пунктирная кривая, и точка эквивалентности может быть неверно определена. Для кривых титрования, подобных кривой 3, погрешность разбавления важна только после точки эквивалентности, т.к. до неё титруемый раствор бесцветен. Поправки на объём важны также и для других типов кривых. Для того, чтобы свести погрешность к минимуму, необходимо применять концентрированный рабочий раствор, объем которого измеряется полумикробюреткой. В случае, если разбавление не превышает нескольких процентов, погрешностью разбавления можно пренебречь[5].
Если фотометрическое титрование проходит в области длин волн более 350 нм, то можно использовать обычные стаканы из пирексового стекла, однако важно, чтобы стакан был защищен от рассеянного света и был зафиксирован во время проведения всего метода, т.к. боковое освещение или поворот могут существенно изменить оптические характеристики анализируемого раствора. Если фотометрическое титрование проходит в области длин волн менее 350 нм, то необходимо применять кварцевые кюветы или кюветы из боросиликатного стекла. В этом случае титрант подается в кювету из полумикробюретки, кончик которой помещён в стакан вблизи поверхности анализируемого раствора. Перемешивание раствора может осуществляться током углекислого газа, азота, механической или магнитной мешалками[5].
Ошибка титрования зависит как от концентрации вещества, так и от коэффициента пропускания и его изменения и изменения оптической плотности. Она будет тем меньше, чем больше значение молярного коэффициента светопоглощения, однако растворы, которые титруются при максимальной длине волны, даже с небольшой концентрацией, но существенной толщиной кюветы будут сильно поглощать свет, что вызовет значительные погрешности при измерении оптической плотности и коэффициента пропускания. Следовательно, необходимо опытным путём выбирать такую длину волны, при которой значение молярного коэффициента светопоглощения было бы достаточно велико, и одновременно с этим изменение поглощения во время проведения метода происходило бы в удобных для его измерения пределах[5].
Преимущества метода
Фотометрическое титрование имеет следующие преимущества[5].
- Позволяет быстро, просто и с высокой воспроизводимостью результатов проводить анализ. Если объём титранта измерен с достаточной степенью точности, то ошибка титрования зависит исключительно от погрешности определения концентрации рабочего раствора.
- Можно проводить титрование очень разбавленных растворов с высокой воспроизводимостью, а также сильно крашенных и даже мутных растворов. Абсолютные содержания веществ, определяемых этим методом, лежат в пределах 1·10-1—2·10-8 г.
- Можно проводить во многих случаях, когда изменения окраски раствора плохо различаются глазом. Применение фотоэлементов, фотосопротивлений, фотодиодов и фотоумножителей в качестве приёмников света, прошедшего через исследуемый раствор, позволяет получать объективные данные и проводить титрование не только окрашенных, но и «бесцветных» для глаза растворов, поглощающих излучение в ультрафиолетовой и ближней инфракрасной областях спектра, что значительно расширяет возможности титриметрического определения многих элементов.
- Процесс легко может быть автоматизирован.
Применение метода
Фотометрическое титрование, как правило, обеспечивает более точные результаты, чем прямой фотометрический анализ, так как для определения конечной точки объединяются данные нескольких измерений. Помимо этого, поскольку при фотометрическом титровании измеряется только изменение оптической плотности, присутствием других поглощающих веществ можно пренебречь[8].
Фотометрическое титрование широко используется, так как явление поглощения оптического излучения в УФ- или видимой области спектра свойственно многим веществам. Объектами фотометрического титрования могут служить неорганические и органические вещества различной химической природы, что позволяет использовать большой ассортимент аналитических титриметрических реакций, которые должны быть количественными, стехиометричными и быстрыми[1].
Фотометрическое фиксирование конечной точки применимо ко всем типам реакций. Большинство реагентов, которые используются в оксидиметрии, имеют характерный спектр поглощения, что позволяет обнаруживать конечную точку фотометрическим методом. При фотометрическом кислотно-основном титровании нашли применение кислотно-основные индикаторы. Фотометрическое определение конечной точки применяют также при титровании раствором ЭДТА и другими комплексообразующим реагентами. При осадительном титровании суспензия твёрдого осадка вызывает ослабление интенсивности излучения вследствие рассеяния, и титрование продолжают до появления постоянного помутнения[8][9].
Данный метод часто применяют при определении кальция в сыворотке, моче, спинномозговой жидкости, а также в воде, водорастворимой части гипса, кварце, цементе, силикатах, стали. В качестве индикаторов в этом случае используют, как правило, мурексид, а также металлфталеин и кальцеин. Фотометрическим титрование определяют также и содержание магния в анализируемом веществе, где индикатором выступает эриохром черный Т. Помимо этого, данный метод анализа применяют и для определениях многих других металлов, используя разнообразные индикаторы. Так, алюминий определяют в присутствии хромазурола S, висмут и медь — пирокатехинового фиолетового, железо определяют, используя салициловую кислоту[10].
Примечания
- В. Д. Безуглый, Т. А. Худякова, А. М. Шкодин и др. Титриметрические методы анализа неводных растворов. — М.: Химия, 1986. — С. 264—306. — 384 с.
- Б. А. Чакчир, Г. М. Алексеева. Фотометрические методы анализа: Методические указания. — СПб.: Издательство СПХФА, 2002. — С. 25—27. — 44 с. — ISBN 5-8085-0044-3.
- Г. Юинг. Инструментальные методы химического анализа. — М.: Госхимиздат, 1960. — С. 234—238.
- Г. Юинг. Инструментальные методы химического анализа. — М.: Мир, 1989. — С. 89—91. — 608 с. — ISBN 5-03-000194-8.
- М. И. Булатов, И. П. Калинкин. Практическое руководство по фотометрическим методам анализа. — Л.: Химия, 1986. — С. 216—239. — 432 с.
- Н. Н. Федоровский, Л. М. Якубович, А. И. Марахова. Фотометрические методы анализа. — М.: ФЛИНТА, 2012. — С. 23—26. — 72 с. — ISBN 978-5-9765-1323-5.
- А. П. Крешков. Основы аналитической химии. Физико-химические (инструментальные) методы анализа. — М.: Химия, 1970. — Т. 3. — С. 265—270. — 472 с.
- Д. Скуг, Д. Уэст. Основы аналитической химии. — М.: Мир, 1979. — Т. 2. — С. 157—160. — 438 с.
- О. М. Петрухин. Практикум по физико-химическим методам анализа. — М.: Химия, 1987. — С. 82—87. — 248 с.
- Г. Шварценбах, Г. Флашка. Комплексонометрическое титрование. — М.: Химия, 1970. — С. 98—106. — 360 с.