Структура Холлидея
Структу́ра Холлиде́я[1] (англ. Holliday junction) — структура из четырёх цепей нуклеиновых кислот, соединённых друг с другом водородными связями с образованием четырёх двуцепочечных ветвей. Эти ветви могут принимать несколько различных конформаций в зависимости от концентрации солей в окружающем буферном растворе и последовательности нуклеотидов, располагающихся в непосредственной близости от точки соединения. Структура названа в честь английского молекулярного биолога Робина Холлидея, который предположил её существование в 1964 году.
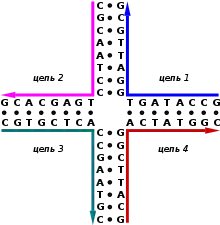
В живых клетках структуры Холлидея являются важными промежуточными соединениями, возникающими при процессах генетической рекомбинации и репарации двуцепочечных разрывов. Как правило, эти структуры имеют симметричные последовательности нуклеотидов и потому обладают некоторой мобильностью, то есть отдельные двуцепочечные ветви могут скользить с сохранением структуры соединения и паттерна спаривания азотистых оснований. Структуры из четырёх цепей, похожие на структуры Холлидея, также обнаруживаются в некоторых молекулах РНК.
Неподвижные структуры Холлидея с несимметричными последовательностями, которые фиксируют структуру в строго определённом положении, были созданы искусственно с целью изучения их структуры как модели природных структур Холлидея. Позднее такие структуры нашли применение в качестве основных строительных структурных блоков в ДНК-нанотехнологиях: несколько структур Холлидея могут быть собраны в единую конструкцию с определённой геометрией, образуя молекулы с высокой степенью структурной жёсткости.
Структура
Стэкинг в структурах Холлидея


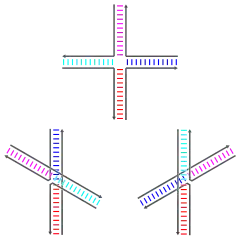
Структуры Холлидея могут существовать в виде различных конформационных изомеров (конформеров), различающихся способами коаксиального стэкинга между четырьмя двуцепочечными ветвями. Коаксиальный стэкинг заключается в склонности тупых концов в структурах нуклеиновых кислот к связыванию друг с другом посредством связывания выставленных наружу азотистых оснований. Существуют три различных конформера, различающихся стэкингом: форма, лишённая коаксиального стэкинга, и две формы с коаксиальным стэкингом. Форма без стэкинга преобладает в отсутствие катионов двухвалентных металлов, например, Mg2+, в силу электростатического отталкивания отрицательно заряженных остовов цепей. В присутствии уже хотя бы 0,1 мМ Mg2+ электростатическое отталкивание нейтрализуется, и преобладают структуры со стэкингом[2].
Формы, лишённые стэкинга, имеют почти плоскую квадратную структуру. Конформеры со стэкингом состоят из двух двуцепочечных доменов, расположенных под углом 60° по правилу правой руки. Две из четырёх цепей (по одной из каждого домена) сохраняют спиральную структуру, а две другие переходят из одного домена в другой антипараллельным образом[2].
Два возможных конформера со стэкингом различаются тем, в каких именно цепях происходит стэкинг. Преобладание одной из форм в значительной мере определяется конкретной последовательностью нуклеотидов вблизи точки соединения. Некоторые из этих последовательностей таковы, что два конформера находятся в равновесии друг с другом, в то время как другие последовательности определяют выраженное преобладание одного из конформеров. Так, в соединениях Холлидея, у которых в точке соединения четырёх цепей находится последовательность A-CC, значительно преобладает тот конформер, который позволяет образовываться водородным связям между вторым цитозином и одним из фосфатов в точке соединения[2].
В соединениях Холлидея с симметричными последовательностями точка соединения четырёх цепей (точка ветвления) может перемещаться по модели случайного блуждания. Скорость перемещения точки ветвления значительно варьирует в зависимости от концентрации ионов: если в отсутствие ионов продолжительность одного акта смещения составляла 0,3−0,4 мс, то в присутствии 10 мМ Mg2+ она составляла 270−300 мс. Изменение скорости связано с образованием структур со стэкингом вместо структур без стэкинга[2].
Если в соединении Холлидея происходит одноцепочечный разрыв, то точка соединения принимает перпендикулярную ориентацию и образуется форма со стэкингом (см. рис.)[2].
Соединения Холлидея из РНК принимают антипараллельную конформацию со стэкингом при высоких концентрациях магния, перпендикулярную конформацию со стэкингом при средних концентрациях и параллельную конформацию со стэкингом при низких концентрациях; однако даже при малых концентрациях кальция они принимают антипараллельную структуру[2].
Биологические функции
Соединение Холлидея является ключевым интермедиатом, образующимся при гомологичной рекомбинации, а также при сайт-специфичной рекомбинации, в которой принимают участие интегразы. Кроме того, оно образуется при репарации двуцепочечных разрывов. Наконец, крестообразные структуры, включающие соединения Холлидея, могут образовываться с целью ослабления спирального напряжения в симметричных последовательностях в суперспиралях ДНК[3]. Четырёхцепочечные структуры, встречающиеся в некодирующих РНК, например, в сплайсосомной РНК U1 и содержащем шпильку рибозиме вируса кольцевой пятнистости табака, обычно содержат неспаренные нуклеотиды между двуцепочечными участками и потому, строго говоря, не являются соединениями Холлидея[2].
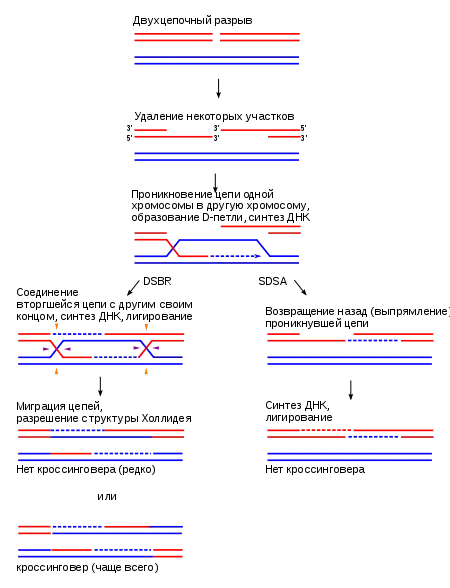
В ходе гомологичной рекомбинации соединения Холлидея образуются между идентичными или почти идентичными последовательностями, в результате чего цепи располагаются симметрично относительно центральной точки ветвления. Это позволяет происходить процессу миграции ветвей, при котором цепи перемещаются через точку соединения[2]. Разрезание, или разрешение структуры Холлидея может осуществляться двумя путями, один из которых приводит к кроссинговеру, при котором образуются две рекомбинантные цепи, а другой — к конверсии генов, в результате которой образуется только одна рекомбинантная цепь[4].
Многие белки могут распознавать и искажать структуру соединения Холлидея. Таковы, например, ферменты, которые способны к разрушению соединений Холлидея, иногда зависимым от последовательностей образом. Эти белки по-разному нарушают структуру соединения Холлидея, часто переводя соединение Холлидея в конформацию без стэкинга, разрушая центральные пары оснований и/или изменяя углы между четырьмя цепями. Другие белки, распознающие соединения Холлидея — белки точки ветвления, которые усиливают темпы рекомбинации на порядок, а также сайт-специфичные рекомбиназы[2]. У прокариот ферменты, разрешающие соединения Холлидея (резольвазы), делятся на два семейства — интегразы и нуклеазы. Эти белки структурно схожи, несмотря на отсутствие консервативности в последовательностях[4].
У эукариот репарация двуцепочечных разрывов посредством гомологичной рекомбинации может осуществляться двумя различными путями: путём репарации двуцепочечных разрывов (DSBR), часто также называемым моделью двойного соединения Холлидея, и путём синтезозависимого выпрямления цепей (SDSA)[5]. При двуцепочечном разрыве 3'-конец одной из цепей разрушается, а более длинный 5'-конец подходит к одной из сестринских хроматид другой хромосомы и связывается с ней; в результате образуется репликационный «пузырь». Когда «пузырь» подходит к месту разрыва ДНК, более длинный 5'-конец антисмысловой цепи вновь связывается со смысловой цепью. Далее происходит синтез недостающих участков ДНК с использованием в качестве матриц сестринской хроматиды из другой гомологичной хромосомы. Когда в конце заполнения брешей разъединённые концы сестринских хроматид соединяются друг с другом, образуются две структуры Холлидея, которые потом разрешаются при помощи разнообразных белков[6].
У бактерий двуцепочечные разрывы в ДНК репарируются белком RecBCD по механизму гомологичной рекомбинации. Репарация одноцепочечных разрывов происходит по варианту гомологичной рекомбинации, известному как RecF-путь. В ходе этих двух путей (RecBCD и RecF) происходят такие процессы, как миграция ветвей, при которой происходит обмен одноцепочечными фрагментами ДНК между двумя перекрещенными молекулами ДНК, и разрешение, при котором перекрещенные молекулы ДНК отделяются друг от друга и возвращаются в своё нормальное двуцепочечное состояние[7]. У бактерий миграция ветвей облегчается комплексом RuvABC и белком RecG — белковыми молекулярными моторами, которые используют энергию гидролиза АТР для перемещения соединения. После этого соединения Холлидея должно разрешиться на два раздельных дуплекса ДНК, возвращая исходное или рекомбинированное состояние. В миграции цепей участвуют белки RuvA и RuvB, в то время как RuvC разрешает соединение Холлидея[8][2].
Гомологичная рекомбинация описана у нескольких групп вирусов. У ДНК-содержащих вирусов (например, герпесвирусов) рекомбинация осуществляется по пути разрыва-воссоединения — подобно тому, как это происходит у бактерий и эукариот[9]. Имеются доказательства существования рекомбинации у РНК-содержащих вирусов, особенно у вирусов, содержащих одноцепочечную РНК положительной полярности — таких, как ретровирусы, коронавирусы и пикорнавирусы; ситуация с вирусами, содержащими РНК отрицательной полярности (например, с вирусом гриппа), более спорная[10].
Разрешение соединений Холлидея
У дрожжей Saccharomyces cerevisiae разрешение структур Холлидея может происходить четырьмя различными путями[11]. Путь, наиболее часто приводящий к кроссинговеру у дрожжей и, возможно, млекопитающих, включает белки EXO1, гетеродимер MLH1—MLH3 (известный как MutL гамма) и SGS1 (ортолог белка синдрома Блума)[11]. MLH1—MLH3 связывается преимущественно с соединениями Холлидея[12]. Он является эндонуклеазой, которая вносит одноцепочечные разрывы в сверхспирализованную двуцепочечную ДНК и способствует кроссинговеру[12][13]. В то время как три других пути, в которые вовлечены белки MUS81—MMS4, SIX1 и YEN1 соответственно, могут способствовать разрешению соединений Холлидея in vivo, отсутствие этих трёх нуклеаз лишь незначительно снижает частоту кроссинговера. Двойные мутанты, лишённые и MLH3, и MMS4, демонстрировали значительное снижение частоты кроссинговера по сравнению с диким типом; впрочем, разъединение хромосом в большинстве случаев происходило без ошибок, и жизнеспособность спор дрожжей была довольно высокой (62 %)[14][14].
Хотя белок MUS81 является компонентом малого пути кроссинговера при мейозе у почкующихся дрожжей, растений и позвоночных, у инфузории Tetrahymena thermophila он задействован в необходимом, но не доминирующем пути кроссинговера. У делящихся дрожжей Schizosaccharomyces pombe путь с участием MUS81 является доминирующим механизмом кроссинговера[15].
Белки MSH4 и MSH5 образуют гетеродимер у человека и дрожжей[16][17][18]. У дрожжей он облегчает кроссинговер между гомологичными хромосомами при мейозе[16]. Комплекс MSH4/MSH5 связывает и стабилизирует двойные соединения Холлидея, способствуя их разрешению с образованием рекомбинантных цепей. У мутантов S. cerevisiae с частично функциональным MSH4 количество кроссинговеров на геном снижено на 30 %, и во многих случаях мейоз не сопровождается рекомбинацией. Тем не менее, споры этого мутанта жизнеспособны, поэтому разделение гомологичных хромосом происходит правильно. Таки образом, у S. cerevisiae разделение хромосом при мейозе не целиком зависит от кроссинговера[19].
Использование в ДНК-нанотехнологиях

ДНК-нанотехнологии занимаются разработкой и производством искусственных нуклеиновых кислот, которые не несут генетической информации, как в живых клетках, а выступают в роли материалов для нанотехнологий. Разветвлённые структуры ДНК используются в качестве элементарных единиц для создания более сложных спроектированных структур. В состав многих таких структур ДНК входят соединения Холлидея. Одиночные соединения Холлидея слишком гибки для того, чтобы быть способными к сборке в длинные упорядоченные ряды, поэтому в качестве жёстких единиц для сборки крупных единиц используются структурные мотивы, содержащие несколько соединений Холлидея[20][21].
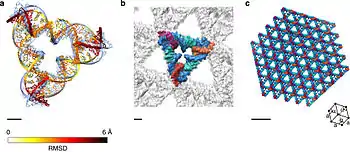
Из таких мотивов наиболее часто используется комплекс двойного кроссинговера (DX), который содержит два соединения Холлидея, расположенных близко друг к другу, в результате чего образуется жёсткая структура, которая может самостоятельно собираться в ряды более высокого порядка. В молекуле DX соединения Холлидея ориентированы так, что их двуцепочечные участки располагаются бок о бок, а не под более предпочтительным углом 60°. Комплекс можно спроектировать таким образом, чтобы соединения располагались в параллельной или антипараллельной ориентации, однако на практике антипараллельная ориентация более удобна, и параллельная используется редко[20][21].
Структурный мотив DX является элементарным строительным блоком в методе ДНК-оригами, который используется для создания более крупных дву- и трёхмерных структур произвольной формы. Сборка длинных протяжённых «лент» осуществляется не из отдельных единиц DX, а из двуцепочечных нитей ДНК; эти нити укладываются в правильную форму при помощи вспомогательных цепей, которые образуют соединения Холлидея как цепи, участвующие в кроссиновере[23].
Некоторые строительные единицы, используемые в ДНК-нанотехнологиях, сохраняют присущий соединениям Холлидея угол 60°. Например, в таких единицах 4 соединения Холлидея могут образовывать параллелограмм. Эта структура интересна тем, что она позволяет непосредственно визуализировать угол в соединении при помощи атомно-силовой микроскопии. Блоки из трёх соединений Холлидея, собранных в треугольник, использовались для создания трёхмерных периодических структур, применявшихся в рентгеноструктурном анализе биомолекул[20][21].
История изучения
В 1964 году английский учёный Робин Холлидей (1932—2014) предположил структуру соединения, которая теперь носит его имя, как часть своей модели гомологичной рекомбинации, разработанной на его исследованиях грибов Ustilago maydis и Saccharomyces cerevisiae. Эта модель рассматривала молекулярные механизмы кроссинговера и конверсии генов. Холлидей понял, что в ходе кроссинговера должны образовываться гетеродуплексы ДНК с некоторыми неспаренными основаниями ввиду небольших различий между вариантами (аллелями) одного гена. Он предположил, что в клетке должен существовать механизм исправления неспаренных оснований, и такой механизм, действительно, был открыт[4]. До модели Холлидея господствовала модель избирательного копирования, согласно которой новая цепь синтезировалась непосредственно из частей различных родительских цепей[24][25].
В оригинальной модели Холлидея гетеродуплексная ДНК образовывалась в обеих гомологичных хромосомах, однако экспериментальные данные, полученные на дрожжах, опровергли это. В 1975 году Метью Мезельсон и Чарли Рэддинг обновили модель и ввели идею миграции цепей[24]. Дальнейшие наблюдения привели в 1980-е годы к разработке альтернативных моделей рекомбинации — таких, как модель двуцепочечных разрывов и модель выпрямления цепей. Третья модель — модель синтезозависимого выпрямления цепей — не предполагала образования соединений Холлидея[4].
Первое экспериментальное доказательство существования соединений Холлидея было получено в конце 1970-х годов при помощи электронной микроскопии, где на изображениях ДНК плазмид и бактериофагов были отчётливо видны структуры из четырёх цепей. В 1980-е годы были идентифицированы ферменты, отвечающие за инициацию образования соединений Холлидея и связывание с ними. В 1983 году Надриан Симэн впервые получил искусственные структуры Холлидея из синтетических олигонуклеотидов, что открыло возможности для более детального изучения свойств структур Холлидея. Многие ранние исследования соединений Холлидея были основаны на таких методах, как электрофорез, FRET и других. В 1990-х годах стали доступны кристаллография и ЯМР нуклеиновых кислот, а также компьютерные методы молекулярного моделирования[2][4][26].
Первоначально генетики предполагали, что для соединения Холлидея более характерна параллельная, а не антипараллельная конформация, поскольку в этом случае гомологичные дуплексы располагались бы наиболее близко друг к другу. Химический анализ, проведённый в 1980-х годах, показал, что преобладает антипараллельная конформация; эти данные показались столь противоречивыми, что поначалу сам Робин Холлидей отверг их[2]. Впоследствии представление об антипараллельной конформации получило большее признание благодаря данным рентгеноструктурного анализа молекул in vitro. В условиях in vivo ситуация менее однозначна, так как связывающиеся с соединениями Холлидея белки могут менять их конформацию[4].
Концептуальные основы использования соединений Холлидея в ДНК-нанотехнологиях были заложены Симэном в начале 1980-х годов. В 1982—1983 годах были разработаны и созданы неподвижные соединения Холлидея[27].
Примечания
- Молекулярная биология клетки: в 3-х томах / Б. Альбертс, А. Джонсон, Д. Льюис и др.. — М.—Ижевск: НИЦ «Регулярная и хаотическая динамика», Институт компьютерных исследований, 2013. — Т. I. — С. 466—483. — 808 с. — ISBN 978-5-4344-0112-8.
- Lilley D. M. Structures of helical junctions in nucleic acids. (англ.) // Quarterly reviews of biophysics. — 2000. — Vol. 33, no. 2. — P. 109—159. — PMID 11131562.
- Bloomfield, Victor A.; Crothers, Donald M.; Tinoco, Jr., Ignacio. Nucleic acids: structures, properties, and functions (англ.). — Sausalito, California: University Science Books, 2000. — P. 468. — ISBN 0935702490.
- Liu Y., West S. C. Happy Hollidays: 40th anniversary of the Holliday junction. (англ.) // Nature reviews. Molecular cell biology. — 2004. — Vol. 5, no. 11. — P. 937—944. — doi:10.1038/nrm1502. — PMID 15520813.
- Sung P., Klein H. Mechanism of homologous recombination: mediators and helicases take on regulatory functions. (англ.) // Nature reviews. Molecular cell biology. — 2006. — Vol. 7, no. 10. — P. 739—750. — doi:10. 1038/nrm2008. — PMID 16926856.
- Hartel, Daniel L.; Jones, Elizabeth W. Chapter 6: Molecular Biology of DNA Replication and Recombination // Genetics: Analysis of Genetics and Genomes (англ.). — Burlington: Jones & Bartlett, 2009.
- Rocha E. P., Cornet E., Michel B. Comparative and evolutionary analysis of the bacterial homologous recombination systems. (англ.) // PLoS genetics. — 2005. — Vol. 1, no. 2. — P. e15. — doi:10.1371/journal.pgen.0010015. — PMID 16132081.
- Kowalczykowski S. C. Initiation of genetic recombination and recombination-dependent replication. (англ.) // Trends in biochemical sciences. — 2000. — Vol. 25, no. 4. — P. 156—165. — PMID 10754547.
- Fleischmann Jr, W. R. Chapter 43 // Medical Microbiology (неопр.). — 4th. — University of Texas Medical Branch at Galveston, 1996. — ISBN 0-9631172-1-1.
- Boni M. F., de Jong M. D., van Doorn H. R., Holmes E. C. Guidelines for identifying homologous recombination events in influenza A virus. (англ.) // Public Library of Science ONE. — 2010. — Vol. 5, no. 5. — P. e10434. — doi:10.1371/journal.pone.0010434. — PMID 20454662.
- Zakharyevich K., Tang S., Ma Y., Hunter N. Delineation of joint molecule resolution pathways in meiosis identifies a crossover-specific resolvase. (англ.) // Cell. — 2012. — Vol. 149, no. 2. — P. 334—347. — doi:10.1016/j.cell.2012.03.023. — PMID 22500800.
- Ranjha L., Anand R., Cejka P. The Saccharomyces cerevisiae Mlh1-Mlh3 heterodimer is an endonuclease that preferentially binds to Holliday junctions. (англ.) // The Journal of biological chemistry. — 2014. — Vol. 289, no. 9. — P. 5674—5686. — doi:10.1074/jbc.M113.533810. — PMID 24443562.
- Rogacheva M. V., Manhart C. M., Chen C., Guarne A., Surtees J., Alani E. Mlh1-Mlh3, a meiotic crossover and DNA mismatch repair factor, is a Msh2-Msh3-stimulated endonuclease. (англ.) // The Journal of biological chemistry. — 2014. — Vol. 289, no. 9. — P. 5664—5673. — doi:10.1074/jbc.M113.534644. — PMID 24403070.
- Sonntag Brown M., Lim E., Chen C., Nishant K. T., Alani E. Genetic analysis of mlh3 mutations reveals interactions between crossover promoting factors during meiosis in baker's yeast. (англ.) // G3 (Bethesda, Md.). — 2013. — Vol. 3, no. 1. — P. 9—22. — doi:10.1534/g3.112.004622. — PMID 23316435.
- Lukaszewicz A., Howard-Till R. A., Loidl J. Mus81 nuclease and Sgs1 helicase are essential for meiotic recombination in a protist lacking a synaptonemal complex. (англ.) // Nucleic acids research. — 2013. — Vol. 41, no. 20. — P. 9296—9309. — doi:10.1093/nar/gkt703. — PMID 23935123.
- Pochart P., Woltering D., Hollingsworth N. M. Conserved properties between functionally distinct MutS homologs in yeast. (англ.) // The Journal of biological chemistry. — 1997. — Vol. 272, no. 48. — P. 30345—30349. — PMID 9374523.
- Winand N. J., Panzer J. A., Kolodner R. D. Cloning and characterization of the human and Caenorhabditis elegans homologs of the Saccharomyces cerevisiae MSH5 gene. (англ.) // Genomics. — 1998. — Vol. 53, no. 1. — P. 69—80. — doi:10.1006/geno.1998.5447. — PMID 9787078.
- Bocker T., Barusevicius A., Snowden T., Rasio D., Guerrette S., Robbins D., Schmidt C., Burczak J., Croce C. M., Copeland T., Kovatich A. J., Fishel R. hMSH5: a human MutS homologue that forms a novel heterodimer with hMSH4 and is expressed during spermatogenesis. (англ.) // Cancer research. — 1999. — Vol. 59, no. 4. — P. 816—822. — PMID 10029069.
- Krishnaprasad G. N., Anand M. T., Lin G., Tekkedil M. M., Steinmetz L. M., Nishant K. T. Variation in crossover frequencies perturb crossover assurance without affecting meiotic chromosome segregation in Saccharomyces cerevisiae. (англ.) // Genetics. — 2015. — Vol. 199, no. 2. — P. 399—412. — doi:10.1534/genetics.114.172320. — PMID 25467183.
- Seeman N. C. Nanotechnology and the double helix. (англ.) // Scientific American. — 2004. — Vol. 290, no. 6. — P. 64—69. — PMID 15195395.
- Seeman N. C. Nanomaterials based on DNA. (англ.) // Annual review of biochemistry. — 2010. — Vol. 79. — P. 65—87. — doi:10.1146/annurev-biochem-060308-102244. — PMID 20222824.
- Pan K., Kim D. N., Zhang F., Adendorff M. R., Yan H., Bathe M. Lattice-free prediction of three-dimensional structure of programmed DNA assemblies. (англ.) // Nature communications. — 2014. — Vol. 5. — P. 5578. — doi:10.1038/ncomms6578. — PMID 25470497.
- Saccà B., Niemeyer C. M. DNA origami: the art of folding DNA. (англ.) // Angewandte Chemie (International ed. in English). — 2012. — Vol. 51, no. 1. — P. 58—66. — doi:10.1002/anie.201105846. — PMID 22162047.
- Stahl F. W. The Holliday junction on its thirtieth anniversary. (англ.) // Genetics. — 1994. — Vol. 138, no. 2. — P. 241—246. — PMID 7828807.
- Advances in genetics (неопр.). — Academic Press, 1971. — ISBN 9780080568027.
- Hays F. A., Watson J., Ho P. S. Caution! DNA crossing: crystal structures of Holliday junctions. (англ.) // The Journal of biological chemistry. — 2003. — Vol. 278, no. 50. — P. 49663—49666. — doi:10.1074/jbc.R300033200. — PMID 14563836.
- Pelesko, John A. Self-assembly: the science of things that put themselves together (англ.). — New York: Chapman & Hall/CRC, 2007. — P. 201, 242, 259. — ISBN 978-1-58488-687-7.