Реакция Прато
Реакция Прато в химии фуллеренов — это функционализация фуллеренов и нанотрубок 1,3-диполярным присоединением азометиновых илидов.[1] Так, в нижеприведенном примере, ставится реакция с обратным холодильником аминокислоты саркозина с параформальдегидом в толуоле, при которой образуется илид. Последний в момент образования реагирует с 6,6-двойной связью фуллерена (1,3-диполярное присоединение). Продукт реакции N-метилпирролидиновое производное, пирролидинофуллерен или пириллидино3,4:1,2[60]фуллерен получается с 82% выходом.
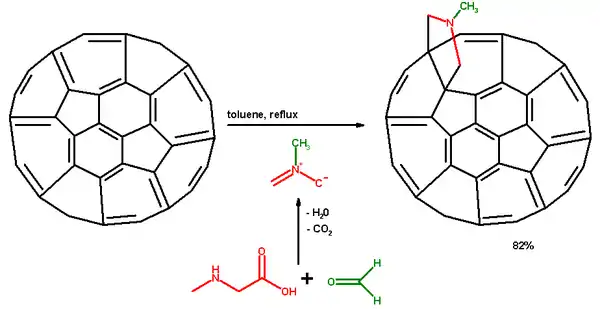
Этот же метод также используется для функционализации одностенных нанотрубок.[2] При модифицировании глицинового остатка аминокислоты производные нанотрубок получаются растворимыми в обычных растворителях, таких как хлороформ и ацетон. Другой особенностью модифицированных нанотрубок является их "набухание" по сравнению с необработанными нанотрубками.
Как и в случае других реакций, используемых для функционализации фуллеренов, таких как реакция Бингеля или реакция Дильса-Альдера, это реакция обратима. Термическое ретро-циклоприсоединение пиридинофуллерена с сильными диполярофилами, такими как малеиновая кислота, в присутствии катализатора (катализатор Уилкинсона или трифлат меди) в 1,2-дихлоробензоле с обратным холодильником в течение 8—18 часов приводит к исходному фуллерену С60.[3] Диполярофил требуется в 30-кратном избытки и захватывает илид, что смещает равновесие в сторону образования С60. N-метилпирролидиновое производное реагирует слабо (5%-ый выход) и для повышения выхода необходимо замещение азотсодержащего кольца в α-положение метильной, фенильной группами или сложноэфирным остатком.
Альтернативным методом функционализации нанотрубок — реакция с N-оксидом триметиламина и диизопропиламидом лития (LDA)[4] с обратным холодильником в тетрагидрофуране. При этом на 16 углеродных атомов нанотрубок приходится 1 функциональная группа. Если же амин содержит ароматическую группу, например пирен, реакция протекает даже при комнатной температуре, поскольку эта группа предварительно ориентируется у поверхности нанотрубки перед реакцией благодаря π-стэкингу.
В одном из модификаций метода, был получен жидкий фуллерен (обычно фуллерены находятся в твёрдом состоянии) при введении пирролидинового заместителя 2,4,6-трис(алкилокси)фенильной группы.[5] Впрочем, небольшое количество растворителя всё равно необходимо.
Ссылки
- M. Maggini, G. Scorrano and M. Prato. Addition of azomethine ylides to C60: synthesis, characterization, and functionalization of fullerene pyrrolidines (англ.) // J. Am. Chem. Soc. : journal. — 1993. — Vol. 115, no. 21. — P. 9798—9799. — doi:10.1021/ja00074a056.
- V. Georgakilas, K. Kordatos, M. Prato, D. M. Guldi, M. Holzinger and A. Hirsch. Organic Functionalization of Carbon Nanotubes (англ.) // J. Am. Chem. Soc. : journal. — 2002. — Vol. 124, no. 5. — P. 760—761. — doi:10.1021/ja016954m.
- N. Martín, M. Altable, S. Filippone, A. Martín-Domenech, L. Echegoyen and C. M. Cardona. Retro-Cycloaddition Reaction of Pyrrolidinofullerenes (англ.) // Angewandte Chemie International Edition : journal. — 2006. — Vol. 45, no. 1. — P. 110—114. — doi:10.1002/anie.200502556.
- C. Menard-Moyon, N. Izard, E. Doris and C. Mioskowski. Separation of Semiconducting from Metallic Carbon Nanotubes by Selective Functionalization with Azomethine Ylides (англ.) // J. Am. Chem. Soc. : journal. — 2006. — Vol. 128, no. 20. — P. 6552—6553. — doi:10.1021/ja060802f.
- T. Michinobu, T. Nakanishi, J. P. Hill, M. Funahashi and K. Ariga. Room Temperature Liquid Fullerenes: An Uncommon Morphology of C60 Derivatives (англ.) // J. Am. Chem. Soc. : journal. — 2006. — Vol. 128, no. 32. — P. 10384—10385. — doi:10.1021/ja063866z.
Внешние источники
- Elizabeth Wilson. How to make the insoluble soluble: Attaching large organic groups is key to unclumping nanotubes (англ.) // Chemical & Engineering News : journal. — 2002. — 4 February (vol. 80, no. 5).