Пыльцевая трубка
Пыльцевая трубка (лат. tubus pollinicus) — цитоплазматический трубчатый вырост вегетативной клетки пыльцевого зерна семенных растений[1][2][3][4]. Пыльцевая трубка обеспечивает доставку мужских гамет к месту оплодотворения[1]. Подобный способ доставки гамет обозначается термином сифоногамия[5][6].
 |
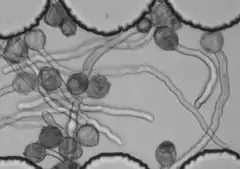 |
Пыльцевые трубки, проросшие в пыльце лилии (Lilium sp.) (вверху) и камелии японской (Camellia japonica L.) (внизу) |
Формирование пыльцевой трубки происходит при прорастании пыльцевого зерна, оказавшегося в оптимальных условиях. Пыльцевые зёрна высвобождаются из микроспорангиев в состоянии физиологического покоя: обезвоженные и с крайне замедленным метаболизмом. В связи с этим прорастанию пыльцевого зерна предшествуют восстановление его водного статуса (регидратация), которая сопровождается изменением формы и восстановлением объёма зерна (гармомегатия)[7][8]. Регидратация инициирует активацию обменных процессов в протопласте вегетативной клетки пыльцевого зерна, образующей трубку.
В лабораторных условиях достаточно легко подобрать соответствующие условия и обеспечить прорастание пыльцевых зёрен в культуре in vitro. В связи с лёгкостью культивации на искусственных средах пыльцевые трубки служит модельной системой для изучения закономерностей полярного клеточного роста, свойственного также корневым волоскам, протонемам мхов, гифам грибов, аксонам нервных клеток[9][10]. Кроме того, пыльцевое зерно и пыльцевая трубка служат удобной моделью для изучения выхода клетки из состояния физиологического покоя.
В естественных условиях прорастание пыльцевого зерна происходит после опыления. Опыление можно определить, как процесс переноса пыльцы с помощью вектора на поверхность рыльца пестика (у покрытосеменных) или в оплодотворительную каплю (у большинства голосеменных). Чаще всего количество пыльцы и образующихся пыльцевых трубок на рыльце или в зародышевой камере превышает число семязачатков, которые могут быть оплодотворены, поэтому пыльцевые трубки вступают в конкуренцию между собой[5][11].
После прорастания пыльцевая трубка покрытосеменных растёт в направлении зародышевого мешка и обеспечивает доставку мужских безжгутиковых гамет (спермиев) для осуществления двойного оплодотворения[1]. Направленность роста обеспечивается сложной системой хемоаттракции[1][12][13]. У покрытосеменных рост пыльцевой трубки происходит по проводниковому тракту столбика пестика, который может представлять собой проводниковую ткань и/или специализированный канал столбика заполненный особым секретом[14].
При достижении зародышевого мешка, пыльцевая трубка входит в него и разрывается, высвобождая при этом цитоплазму, содержащую спермии. Вслед за этим в типе следует слияние одного из спермиев с яйцеклеткой, а второго спермия с диплоидной центральной клеткой (двойное оплодотворение).
История изучения
Одно из первых, однако ошибочных, описаний пыльцевой трубки дал шотландский ботаник Роберт Браун (1773—1858). Браун в некоторых случаях проследил образование пыльцевой трубки из пыльцевого зерна в завязь и микропиле семязачатка. Тем не менее он считал, что пыльцевые трубки могут возникать и в ткани столбика независимо от пыльцевых зёрен[15].
Большего успеха в своих наблюдениях достиг итальянский ботаник Джованни Баттиста Амичи (1786—1863). В 1823 году исследуя рыльце у портулака (Portulaca oleracea) Амичи показал прорастание пыльцевых зёрен и внедрение пыльцевых трубок в ткань рыльца[16][5].
Немногим позднее в 1827 году аналогичные наблюдения над большим числом рылец провел французский ботаник Адольф Теодор Броньяр (1801—1876)[15].
Позднее в 1830 году к изучению роста пыльцевой трубки вернулся Амичи и с определённостью продемонстрировал на портулаке и гибискусе (Hibiscus syriacus), что, образуясь из пыльцевого зерна на рыльце, пыльцевая трубка растет через столбик и проникает в завязь и далее в семезачаток[15]. Немецкий ботаник Матиас Шлейден высказал не подтвердившуюся гипотезу, что пыльцевая трубка несет на своем кончике зародыш маленького растения, а зародышевый мешок семязачатка служит инкубатором в котором зародыш созревает[15]. Подобный ошибочный взгляд на размножение растений, очевидно, находился под влиянием преформизма XVII—XVIII веков. С подобным взглядом Шлейдена согласился молодой немецкий ботаник, ассистент Шлейдена — Герман Шахт[15]. Амичи не согласился с таким взглядом и на съезде итальянских натуралистов в Падуа в 1842 году высказал предположение согласно которому пыльцевая трубка привносит в семезачаток оплодотворяющее вещество, служащее для дальнейшего развития зародыша (эпигенез). В 1847 году Амичи на ятрышнике (Orchis sp.) детально демонстрирует процесс прорастание пыльцевой трубки, её рост и дальнейшее проникновение в семязачаток. Указывает при этом Амичи и на то, что в семезачатке до проникновения пыльцевой трубки имеется «особое тельце» или «зародышевый пузырёк», который под влиянием пыльцевой трубки начинает развиваться и образует в дальнейшем зародыш растения[15].
Также изучением пыльцы занимается чешский ботаник Ян Эвангелиста Пуркинье (1787—1869)[15]. Важную работу «О строении и формах пыльцевых зёрен» классифицирующую пыльцевые зёрна в 1834 году издает выдающийся немецкий ботаник Гуго Фон Моль[15]. Продолжает морфологические исследования пыльцы, работающий в Петербургской Академии наук, ботаник Карл Фрицше (1808—1871) и в 1837 году издает свой труд «О пыльце»[15]. Образование пыльцевых зёрен из материнских клеток продемонстрировал Карл Вильгельм фон Негели в своей работе 1842 года «К истории развития пыльцы»[15].
Культура in vitro
Пыльца многих растений может прорастать на искусственных средах in vitro. Успех культивации зависит от ряда факторов:
- минерального состава среды,
- наличия субстратов для хемогетеротрофного метаболизма (обычно сахароза),
- её кислотности,
- осмотичности,
- плотности среды (могут быть использованы жидкие среды, агаризованные реже желатинизированные).
- Кроме того, значительное влияние на прорастание зёрен и рост пыльцевых трубок оказывает температура.
Минеральный состав и органические компоненты среды
У ряда растений (некоторые представители Орхидных) пыльца прорастает в воде с низким содержанием минеральных солей и в отсутствие сахарозы. Хотя продолжительный рост при этом не возможен.
Роль Ca2+ и H3BO3
Показано, что из минеральных солей важнейшую роль в прорастании зёрен и росте пыльцевых трубок у многих видов играют: кальций (Ca2+)[17] и бор (обычно в форме борной кислоты, H3BO3)[18]. При этом, в некоторых случаях, как например у кукурузы, добавление этих компонентов по отдельности может снижать процент прорастания, а в некоторых случаях и скорость роста[19]. Однако совместное добавление кальция и бора, как правило, увеличивает как процент прорастания, так и скорость роста проросших трубок[19].
Другие компоненты минерального питания
Для оптимизации прорастания и роста, как правило, в среду добавляют и другие соли (K+, NO3-).
Труднокультивируемые группы
Особенно трудно бывает добиться успешного культивирования пыльцы представителей семейств Злаки (Gramineae), Вересковые (Ericaceae), Сложноцветные (Compositae), Льновые (Linaceae)[20].
Клеточное строение
Морфологически пыльцевая трубка представляет собой вырост вегетативной клетки мужского гаметофита цветковых растений. Внутри вегетативной клетки помимо ядра и прочих органелл можно обнаружить генеративную клетку (в двухклеточных пыльцевых зёрнах) или два спермия (в трёхклеточных пыльцевых зёрнах). Если пыльцевое зерно двухклеточное, то во время роста пыльцевой трубки происходит митоз ядра генеративной клетки и цитокинез, в результате чего формируются два спермия.
По мере роста пыльцевой трубки вегетативное ядро и спермии продвигаются вперед, занимая место вблизи растущей вершины трубки. Так они добираются до зародышевого мешка, где и производят оплодотворение[2].
Зонирование цитоплазмы
Для растущей пыльцевой трубки характерно зонирование цитоплазмы[4][21][22]. Можно выделить следующие домены (начиная от растущего апекса):
- Апекс и чистая зона (англ. clear zone). При оптическом микроскопировании данный регион выглядит прозрачным, поскольку здесь в цитоплазме отсутствуют крупные органеллы (пластиды, митохондрии). В цитоплазме чистой зоны много секреторных везикул, отшнуровывающихся от аппарата Гольджи. Везикулы формируют конус, который своим основанием обращен в внутренней поверхности плазматической мембраны.
- Субапикальный домен. Цитоплазма богата метаболически активными органеллами: митохондриями, цистернами эндоплазматического ретикулума (ЭПР), диктиосомами аппарата Гольджи, пластидами.
- Ядерный домен. В этой области располагаются крупные органеллы и мужской гаметный модуль (англ. male germ unit), состоящий из спермиев и ядра вегетативной клетки.
- Вакуолярный домен. Цитоплазма вакуолярного домена практически полностью заполнена крупной вакуолью, увеличивающей по мере роста пыльцевой трубки. В длинных пыльцевых трубках за вакуолярным доменом (ближе к зерну) формируется каллозная пробка, изолирующая базальную часть трубки. Изолированные каллозными пробками сегменты цитоплазмы постепенно отмирают. Таким образом, в длинных трубках живым, метаболически активным, сегментом является только передняя часть.
Цитофизиология
В результате опыления пыльцевое зерно попадает на рыльце пестика. Не обладая органами движения, пыльцевое зерно при помощи роста достигает тех же целей, которых можно было бы достигнуть при помощи органов движения (в этом отношении пыльцевое зерно сходно с органами высших зелёных растений)[2].
Регидратация, активация и поляризация
После попадания обезвоженного пыльцевого зерна на рыльце пестика, происходит его регидратация, активация метаболизма, поляризация цитоплазмы вегетативной клетки и начинается полярный направленный рост.
Регидратация происходит благодаря поступлению воды из тканей рыльца, при этом происходит восстановление объёма и формы пыльцы. Таким образом, в результате регидратации, апертуры — области в которых отсутствует наружная оболочка пыльцевого зерна (экзина) оказываются экспонированы наружу.
В гидратированном пыльцевом зерне активизируется дыхание, синтез белка, ионные токи.
Поляризация включает в себя: реорганизацию цитоскелета, миграцию генеративной клетки (в трёхклеточных зёрнах — спермиев), вегетативного ядра, везикул аппарата Гольджи и митохондрий к апертуре, в области которой произойдет прорастание пыльцевой трубки.
Скорость роста
Среди всех других клеток с полярным ростом, для пыльцевых трубок покрытосеменных характерна, по-видимому, самая высокая скорость удлинения в оптимальных условиях[23]. При этом среди покрытосеменных скорость роста пыльцевой трубки сильно варьирует у разных видов от 10 до более чем 20 000 μмч−1[23]. Для сравнения, средняя скорость удлинения аксонов нейронов и корневых волосков составляет около 20 — 50 μмч−1[24]. Подобные различия не удивительны, поскольку в случае пыльцевых трубок естественный отбор направлен на возможно более быструю доставку спермиев к зародышевому мешку с целью оплодотворения. Именно поэтому в поколениях происходит отбор генов, способных обеспечить наибольшую скорость роста пыльцевой трубки в изменяющихся условиях среды; при обязательном сохранении направленности[5].
Ниже в таблице приводятся средние значения скорости роста пыльцевых трубок в оптимальных условиях для некоторых видов растений. Следует отметить, что удлинение трубки происходит не с нулевым ускорением, то есть рост неравномерный.
| Вид растения | Средняя скорость роста, μмч−1 | Ссылка |
|---|---|---|
| Lilium sp. (Лилия) | 720 — 1 080 | [11][24] |
| Oenothera sp. (Ослинник) | 6 500 | [25][26] |
| Zea sp. (Кукуруза) | 10 080 | [11] |
| Tradescantia sp. (Традесканция) | 14 400 | [27][24][4] |
| Hemerocallis sp. (Лилейник) | 14 400 | [27][24][4] |
| Cichorium intybus (Цикорий) | 39 000 | [1][28] |
Энергообеспечение роста
Быстрый полярный рост возможен только в условиях интенсивного энергетического метаболизма, в ходе которого энергия запасенных в пыльцевом зерне полимеров или энергия веществ поступающих извне преобразуется в конвертируемую форму клеточной энергии — аденозинтрифосфат (АТФ)[29].
Брожение
Спиртовое брожение включает две последовательные реакции[1]:
- декарбоксилирование пирувата при участии пируватдекарбоксилазы (PDC) с образованием ацетальдегида:,
- восстановление ацетальдегида до этанола за счет окисления NADH, которое обеспечивается алкогольдегидрогеназой (ADH):.
Согласно общепринятым представлением различные формы брожения служат для утилизации пировиноградной кислоты, образующейся в ходе гликолиза и регенерации окислителя — NAD+[29]. NAD+ необходим для поддержания гликолитического окисления гексоз и синтеза АТФ в ходе субстратного фосфорилирования в бескислородных (анаэробных) условиях. Такая роль отводится брожению у растений, например, при прорастании семян, кислородном в корнях дефиците в результате затопления[1][30]. Однако, показано, что пыльцевые трубки ряда растений (петуния и табак) образуют значительные количества этанола (до 100 мМ) в ходе спиртового брожения даже в условиях хорошего снабжения кислородом (аэробное брожение)[31]. При этом, в отличие от спорофитных тканей вегетативных органов основным фактором, контролирующим интенсивность брожения оказывается не доступность кислорода, а углеводный состав среды[32]. Тем не менее при нокауте у кукурузы гена алкогольдегидрогеназы, ключевого фермента спиртового брожения обеспечивающего восстановление ацетальдегида и регенерацию NAD+, не наблюдается снижения жизнеспособности пыльцы[33]. Этот факт, указывает на высокую пластичность метаболизма и возможность регенерировать NAD+ за счёт других механизмов, в первую очередь за счёт работы электрон-транспортной цепи дыхания.
Пируватдегидрогеназный комплекс и его цитоплазматический шунт
В вегетативной клетке мужского гаметофита, также как и большинстве других организмов, образующийся в результате гликолиза пируват поступает в матрикс митохондрий, где подвергается окислительному декарбоксилированию при участии пируватдегидрогеназного комплекса (PDH) в результате чего образуется ацетил-КоА, который затем вовлекается в цикл Кребса[30].
Кроме того, показано функционирование цитоплазматического пути шунтирующего пируватдегидрогеназный комплекс (шунт ПДК или англ. PDH bypass)[11][34][35][36]. Данный шунт предполагает последовательное:
- декарбоксилирование пирувата при участии пируват декарбоксилазы (PDC) с образованием ацетальдегида:,
- окисление ацетальдегида до ацетата, которое катализируется ацетальдегид дегидрогеназой (ALDH):,
- конденсацию ацетата и ацетил-КоА с затратой энергии АТФ при участии ацетил-КоА синтазы (ACS) с образование ацетил-КоА:.
Образующийся в цитоплазме ацетил-КоА транспортируется в матрикс митохондрий, где вступает в биохимические реакции цикла Кребса. Важное значение цитоплазматического шунта пируватдегидрогеназного комплекса митохондрий подтверждается генетически. Так, у петунии (Petunia hybrida) с нефункциональным геном специфичной для пыльцы пируват декарбоксилазы (pdc2) наблюдается снижение темпов роста in vitro. А в условиях in vivo, при росте в тканях пестика, пыльца c нокаутированным геном pdc2 проигрывает конкурентную борьбу пыльце дикого типа[36].
Альтернативная оксидаза: шунт III и IV комплексов электрон-транспортной цепи дыхания
Относительно наличия в митохондриях пыльцевой трубки альтернативной оксидазы (AOX) нет однозначного мнения. С одной стороны транскриптомные исследования, показывают присутствие в пыльце модельного растения Arabidopsis thaliana мРНК AOX1A и AOX1B, одновременно и на стадии прорастания зерна и на стадии роста трубки.[37] С другой стороны, изучение протеома, пока не позволило выявить альтернативную оксидазу (AOX) в мужском гаметофите семенных растений[38][39].
Трансмембранный транспорт веществ
АТФ обеспечивает генерацию на плазматической мембране другой формы конвертируемой клеточной энергии — трансмембранного электрохимического градиента протонов — Δμ(H+). Генерацию Δμ(H+) в пыльцевой трубке, как и во всех других клетках растений, обеспечивает H+-АТФаза плазмалеммы P-типа. Δμ(H+) может быть использован другими трансмембранными транспортными системами, в качестве источника энергии для переноса веществ через мембрану против их градиента.
Синтез полисахаридов клеточной оболочки
Экзоцитоз и эндоцитоз
Движение цитоплазмы
Матричные процессы и синтез белков (трансляция)
Осцилляции роста и других процессов
Направленный полярный рост в условиях in vivo
При условии, что не происходит отторжения пыльцевых зёрен (в этом процессе существенную роль играют различные белки), пыльцевая трубка начинает полярный рост в направлении зародышевого мешка. Механизмы ориентации пыльцевой трубки в ткани пестика изучены недостаточно. Предполагается, что пыльцевая трубка растет в направлении химических сигналов, кроме того направленность роста может обеспечиваться окружающими условиями.
Полярный рост характеризуется, локальной секрецией мембранного материала и материала клеточной стенки в кончике растущей трубки. Рост пыльцевых трубок один из наиболее быстрых ростовых процессов среди живых организмов.
Классификация оплодотворения по способу проникновения пыльцевой трубки в семязачаток
В зависимости от того, каким образом пыльцевые трубки попадают в семязачаток — этот процесс подразделяется на следующие типы[40]:
- порогамия — прорастание через микропиле,
- халазогамия — через халазу,
- мезогамия — через интегументы.
Особенности голосеменных растений
У голосеменных пыльцевая трубка образуется в пыльцевой камере семяпочки. Трубка внедряется в ткань нуцеллуса и служит присоской, получающей питательные вещества, или обеспечивает проход мужских гамет к первичному эндосперму. У некоторых растений вещества рыльца и пестика, способствующие прорастанию, вызывают хемотропизм пыльцевой трубки, направляя её рост.
Примечания
- Bob B. Buchanan, Wilhelm Gruissem, and Russell L. Jones. Biochemistry & Molecular Biology of Plants. — Second Edition. — Chichester, West Sussex: John Wiley & Sons, 2015. — С. 902. — 1264 с. — ISBN 9780470714218.
- Пыльцевая трубка // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Пыльцевая трубка — статья из Большой советской энциклопедии.
- Leonor C. Boavida, Ana Maria Vieira, Jorg D. Becker, Jose A. Feijo. Gametophyte interaction and sexual reproduction: how plants make a zygote (англ.) // The International Journal of Developmental Biology. — 2004-09-01. — Vol. 49, iss. 5—6. — P. 615—632. — ISSN 1696-3547 0214-6282, 1696-3547. — doi:10.1387/ijdb.052023lb.
- Jorge Lora, José I. Hormaza, María Herrero. The Diversity of the Pollen Tube Pathway in Plants: Toward an Increasing Control by the Sporophyte // Frontiers in Plant Science. — 2016-02-09. — Т. 7. — ISSN 1664-462X. — doi:10.3389/fpls.2016.00107.
- William E. Friedman. The evolutionary history of the seed plant male gametophyte (англ.) // Trends in Ecology & Evolution. — Cell Press. — Vol. 8, iss. 1. — P. 15—21. — doi:10.1016/0169-5347(93)90125-9.
- Eleni Katifori, Silas Alben, Enrique Cerda, David R. Nelson, Jacques Dumais. Foldable structures and the natural design of pollen grains (англ.) // Proceedings of the National Academy of Sciences. — United States National Academy of Sciences, 2010-04-27. — Vol. 107, iss. 17. — P. 7635—7639. — ISSN 1091-6490. — doi:10.1073/pnas.0911223107.
- N. P. Matveeva, S. V. Polevova, A. V. Smirnova, I. P. Ermakov. [Sporopollenin accumulation in Nicotiana tabacum L. microspore wall during its development] // Tsitologiia. — 2012. — Т. 54, вып. 2. — С. 176—184. — ISSN 0041-3771.
- Tip growth in plant and fungal cells. — San Diego: Academic Press, 1990. — x, 351 pages с. — ISBN 9780123358455.
- Caleb M. Rounds, Magdalena Bezanilla. Growth Mechanisms in Tip-Growing Plant Cells // Annual Review of Plant Biology. — 2013-04-29. — Т. 64, вып. 1. — С. 243—265. — ISSN 1543-5008. — doi:10.1146/annurev-arplant-050312-120150.
- Jennifer Selinski, Renate Scheibe. Pollen tube growth: where does the energy come from? // Plant Signaling & Behavior. — 2014-12-02. — Т. 9, вып. 12. — С. e977200. — doi:10.4161/15592324.2014.977200.
- Tetsuya Higashiyama, Wei-cai Yang. Gametophytic Pollen Tube Guidance: Attractant Peptides, Gametic Controls, and Receptors (англ.) // Plant Physiology. — American Society of Plant Biologists, 2017-01-01. — Vol. 173, iss. 1. — P. 112—121. — ISSN 1532-2548 0032-0889, 1532-2548. — doi:10.1104/pp.16.01571.
- Mihaela-Luiza Márton, Thomas Dresselhaus. Female gametophyte-controlled pollen tube guidance (англ.) // Biochemical Society Transactions. — 2010-04-01. — Vol. 38, iss. 2. — P. 627—630. — ISSN 1470-8752 0300-5127, 1470-8752. — doi:10.1042/bst0380627.
- Е. В. Андронова, Г. М. Анисимова, О. В. Антипова и др. Эмбриология цветковых растений: терминология и концепции / Т. Б. Батыгина. — Санкт-Петербург: Мир и семья, 1997. — Т. 2 Семя. — ISBN 5-86429-018-1.
- А. Л. Тахтаджян. Вопросы эволюционной морфологии растений / Д. В. Лебедев. — Ленинград: Издательство Ленинградского Университета, 1954. — 203 с.
- Amici G. B. Observations microscopiques sur diverses espèces de plantes // Ann. Sci. Nat.. — 1824. — № 2. — С. 41—70.
- J. L. Brewbacker, B. H. Kwack. The essential role of calcium ion in pollen germination and poolen tube growt (англ.) // American Journal of Botany. — Botanical Society of America, 1963. — October (vol. 50, no. 9). — P. 859—865.
- Robert G. Stanley, Elizabeth A. Lichtenberg. The Effect of Various Boron Compounds on in vitro Germination of Pollen (англ.) // Physiologia Plantarum. — 1963-04-01. — Vol. 16, iss. 2. — P. 337—346. — ISSN 1399-3054. — doi:10.1111/j.1399-3054.1963.tb08315.x.
- P. L. Pfahler. In vitro germination and pollen tube growth of maize (Zea mays) pollen. II. Pollen source, calcium, and boron interactions // Canadian Journal of Botany. — 1968-03-01. — Т. 46, вып. 3. — С. 235—240. — ISSN 0008-4026. — doi:10.1139/b68-039.
- В. А. Поддубная-Арнольди. Общая эмбриология покрытосеменных растений / Н. В. Цицин. — Москва: Наука, 1964. — 481 с.
- VE Franklin-Tong. Signaling and the modulation of pollen tube growth // The Plant Cell. — April 1999. — Т. 11, вып. 4. — С. 727—738. — ISSN 1040-4651.
- Alice Y. Cheung, Hen-ming Wu. Structural and Signaling Networks for the Polar Cell Growth Machinery in Pollen Tubes // Annual Review of Plant Biology. — 2008-04-29. — Т. 59, вып. 1. — С. 547—572. — ISSN 1543-5008. — doi:10.1146/annurev.arplant.59.032607.092921.
- David L. Mulcahy, Gabriella Bergamini Mulcahy. The Effects of Pollen Competition (англ.) // American Scientist. — Sigma Xi, 1987. — Vol. 75, iss. 1. — P. 44—50.
- Leonie Steinhorst, Jörg Kudla. Calcium - a central regulator of pollen germination and tube growth // Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. — Т. 1833, вып. 7. — С. 1573—1581. — doi:10.1016/j.bbamcr.2012.10.009.
- Robert G. Stanley. Pollen: Development and Physiology / J. Heslop-Harrison. — London, England. — 1 online resource (351 pages) с. — ISBN 9781483165370.
- L. M. Stone, K. A. Seaton, J. Kuo, J. A. McCOMB. Fast Pollen Tube Growth in Conospermum Species // Annals of Botany. — 2004-04-01. — Т. 93, вып. 4. — С. 369—378. — ISSN 0305-7364. — doi:10.1093/aob/mch050.
- Erwan Michard, Filipa Alves, Jose A. Feijo. The role of ion fluxes in polarized cell growth and morphogenesis: the pollen tube as an experimental paradigm (англ.) // The International Journal of Developmental Biology. — 2009-11-01. — Vol. 53, iss. 8—9—10. — P. 1609—1622. — ISSN 1696-3547 0214-6282, 1696-3547. — doi:10.1387/ijdb.072296em.
- G. Coppens d'Eeckenbrugge. The progamic phase in <Emphasis Type="Italic">Cichorium intybus</Emphasis> L. Pollen tube growth in the style, incompatibility reaction and gametophytic competition (англ.) // Euphytica. — Vol. 48, iss. 1. — ISSN 1573-5060 0014-2336, 1573-5060. — doi:10.1007/bf00028957.
- В.П. Скулачёв, А.В. Богачёв, Ф.О. Каспаринский. Мембранная биоэнергетика: Учебное пособие. — Москва: Издательство Московского университета, 2010. — 268 с. — ISBN 978-5-221-05871-2.
- Н. Д. Алехина, Ю. В. Балнокин, В. Ф. Гавриленко и др. Физиология растений: учебник для студ. вузов / И. П. Ермаков. — Москва: Издательский центр «Академия», 2005. — С. 218. — 640 с. — ISBN 5-7695-1669-0.
- Marcel Bucher, Karl A. Brander, Sandro Sbicego, Therese Mandel, Cris Kuhlemeier. Aerobic fermentation in tobacco pollen (англ.) // Plant Molecular Biology. — 1995-07-01. — Vol. 28, iss. 4. — P. 739—750. — ISSN 1573-5028 0167-4412, 1573-5028. — doi:10.1007/bf00021197.
- Million Tadege, Cris Kuhlemeier*. Aerobic fermentation during tobacco pollen development (англ.) // Plant Molecular Biology. — 1997-10-01. — Vol. 35, iss. 3. — P. 343—354. — ISSN 1573-5028 0167-4412, 1573-5028. — doi:10.1023/a:1005837112653.
- M Freeling, D C Bennett. MAIZE Adhl // Annual Review of Genetics. — 1985-12-01. — Т. 19, вып. 1. — С. 297—323. — ISSN 0066-4197. — doi:10.1146/annurev.ge.19.120185.001501.
- Stefan Mellema, Waldemar Eichenberger, André Rawyler, Marianne Suter, Million Tadege. The ethanolic fermentation pathway supports respiration and lipid biosynthesis in tobacco pollen // The Plant Journal: For Cell and Molecular Biology. — May 2002. — Т. 30, вып. 3. — С. 329—336. — ISSN 0960-7412.
- M Tadege. Ethanolic fermentation: new functions for an old pathway (англ.) // Trends in Plant Science. — Cell Press. — Vol. 4, iss. 8. — P. 320—325. — doi:10.1016/s1360-1385(99)01450-8.
- Nathalie Gass, Tatiana Glagotskaia, Stefan Mellema, Jeroen Stuurman, Mario Barone. Pyruvate Decarboxylase Provides Growing Pollen Tubes with a Competitive Advantage in Petunia (англ.) // The Plant Cell. — 2005-08-01. — Vol. 17, iss. 8. — P. 2355—2368. — ISSN 1532-298X 1040-4651, 1532-298X. — doi:10.1105/tpc.105.033290.
- Yi Wang, Wen-Zheng Zhang, Lian-Fen Song, Jun-Jie Zou, Zhen Su. Transcriptome Analyses Show Changes in Gene Expression to Accompany Pollen Germination and Tube Growth in Arabidopsis (англ.) // Plant Physiology. — American Society of Plant Biologists, 2008-11-01. — Vol. 148, iss. 3. — P. 1201—1211. — ISSN 1532-2548 0032-0889, 1532-2548. — doi:10.1104/pp.108.126375.
- Katarzyna Rafinska, Krzysztof Zienkiewicz, Elzbieta Bednarska. Pollen Transcriptome and Proteome: Molecular and Functional Analysis (англ.) // Advances in Cell Biology. — 2010-01-01. — Vol. 2, iss. 1. — ISSN 2080-2218. — doi:10.2478/v10052-010-0003-9.
- Sota Fujii, Setsuko Komatsu, Kinya Toriyama. Retrograde regulation of nuclear gene expression in CW-CMS of rice (англ.) // Plant Molecular Biology. — 2007-02-01. — Vol. 63, iss. 3. — P. 405—417. — ISSN 1573-5028 0167-4412, 1573-5028. — doi:10.1007/s11103-006-9097-8.
- Биологический словарь. Дата обращения: 1 апреля 2012.