Околоводопроводное серое вещество
Околоводопроводное серое вещество (также известное как периакведуктальное серое вещество или центральное серое вещество среднего мозга) — это скопление серого вещества под водопроводом мозга, анатомически относящееся к покрышке среднего мозга. Околоводопроводное серое вещество направляет свои восходящие проекции в ядра шва и в голубое пятно, а также в соматосенсорные и висцеросенсорные ядра таламуса. Оно также имеет нисходящие проекции в спинной мозг. Восходящие нервные волокна спиноталамического пути, проводящие ощущения боли и температуры, на своём пути в таламус делают промежуточную «остановку» в околоводопроводном сером веществе. Эта часть спиноталамического пути называется спиномезэнцефалическим путём. В свою очередь, воспринимающие болевые и температурные ощущения ядра таламуса направляют свои нисходящие волокна обратной связи к спинному мозгу также через околоводопроводное серое вещество.
| Околоводопроводное серое вещество | |
|---|---|
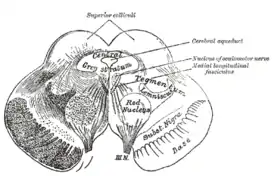
 Разрез через верхние холмики четверохолмия, показывающий путь глазодвигательного нерва. Околоводопроводное серое вещество - это область серого вещества, непосредственно прилегающая к водопроводу мозга. | |
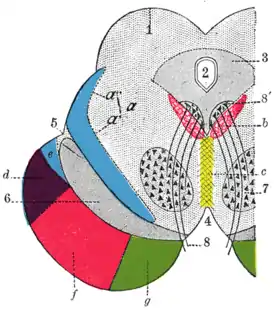 Поперечный разрез через средний мозг. | |
| Каталоги | |
Роль в регуляции болевой чувствительности
Околоводопроводное серое вещество (ОСВ) является одним из основных центров нисходящей регуляции болевой чувствительности, то есть одним из основных центров антиноцицептивной системы. Оно содержит нейроны, производящие энкефалины и уменьшающие восприятие восходящих болевых импульсов из спинного мозга. В эту область нередко вживляют электроды имплантатов устройств ГСМ (глубокой стимуляции мозга) при лечении пациентов с различными хроническими болевыми синдромами.
Этот механизм работает следующим образом: стимуляция околоводопроводного серого вещества активирует его энкефалин-содержащие нейроны, которые затем посылают свой энкефалиновый сигнал к ядрам шва в стволе мозга и к голубоватому пятну. Нервные окончания ядер шва выделяют серотонин, а нервные окончания ядер голубоватого пятна выделяют норадреналин. Нисходящие нервные волокна как от ядер шва, так и от ядер голубоватого пятна идут в желатинозное вещество задних рогов спинного мозга. Там они формируют, соответственно, возбуждающие серотонинергические и возбуждающие норадренергические синапсы с угнетающими (ингибиторными) энкефалинергическими, динорфинергическими или ГАМКергическими вставочными нейронами (интернейронами).
Будучи активированы нисходящим серотонинергическим или норадренергическим сигналом от ядер шва или ядер голубоватого пятна, эти вставочные нейроны выделяют, соответственно, энкефалины, динорфин или ГАМК. Выделяясь на синаптических окончаниях на аксонах входящих в спинной мозг A-delta или C волокон, передающих болевые и температурные ощущения от ноцицепторов с периферии в мозг, эти вещества связываются, соответственно, с угнетающими опиоидными рецепторами подтипов мю, каппа и/или дельта, или с ГАМК-рецепторами. Активация этих рецепторов, в свою очередь, приводит к угнетению активности соответствующего аксона и к уменьшению выделения им субстанции P.
Уменьшение активности этих входящих аксонов от нейронов первого порядка, уменьшение выделения субстанции P в их синаптических терминалях, под влиянием ингибирующих энкефалиновых, динорфиновых или ГАМКергических сигналов, в свою очередь, приводит к угнетению активности нейронов второго порядка, ответственных за передачу болевых и температурных сигналов вверх, по спиноталамическому пути, в вентральное постеролатеральное ядро таламуса.
Таким образом, под влиянием этого механизма передача болевого сигнала прерывается или существенно снижается ещё на этапе вхождения сигнала в задние рога спинного мозга, задолго до достижения этим сигналом фильтров таламуса, и тем более до достижения им тех областей коры больших полушарий, которые осознают этот сигнал и интерпретируют его как боль — таких областей, как передняя поясная кора. Эту теорию называют «теорией воротного контроля боли». Она подтверждается, в частности, тем, что электрическая стимуляция околоводопроводного серого вещества приводит к развитию немедленного и сильного обезболивающего эффекта (анальгезии)[2].
Околоводопроводное серое вещество также активируется при просмотре статических изображений и видео, ассоциирующихся с ощущением боли (например, фотографий и видео драк, бытовых травм или хирургических операций), при восприятии соответствующих, ассоциирующихся с болью, звуков, таких, как крики, стоны, плач, и при восприятии запаха крови или гноя. Во всех этих случаях у смотрящего, слышащего или ощущающего соответствующие образы, звуки или запахи, также заранее возникает анальгезия, хотя ему самому никто в этот момент боли ещё не причиняет[3]. Описанная система называется антиноцицептивной системой мозга[3].
Обезболивающее (анальгетическое) действие поступающих извне в системный кровоток (экзогенных) опиатов и опиоидов, таких, как морфин, героин, кодеин, фентанил, также реализуется по большей части через взаимодействие с опиоидными рецепторами околоводопроводного серого вещества, а также с опиоидными рецепторами вентрального постеролатерального ядра таламуса (центральное, или супраспинальное, анальгетическое действие), и лишь отчасти — через взаимодействие с опиоидными рецепторами желатинозной субстанции в задних рогах спинного мозга (спинальное анальгетическое действие). Однако при введении опиатов и опиоидов эпидурально или субдурально в полость спинномозгового канала их действие, напротив, реализуется преимущественно на спинальном уровне. При этом требуются намного (на десятичный порядок) меньшие их дозы, чем при введении в системный кровоток. Опиоидных рецепторов известно три подтипа: мю, каппа и дельта. Особенности взаимодействия конкретного опиоидного лекарства с разными подтипами опиоидных рецепторов определяют спектр и выраженность его побочных эффектов, таких, как выраженность эйфории и угнетения дыхания.
Анальгетическое действие антидепрессантов реализуется одним-двумя уровнями иерархии антиноцицептивной системы ниже: не в таламусе и не в околоводопроводном сером веществе, а в иннервируемых ОСВ ядрах шва и в ядрах голубоватого пятна. Под влиянием антидепрессантов в этих образованиях повышается концентрация серотонина и норадреналина. Возникающая при этом стимуляция нисходящих серотонинергических и норадренергических волокон, идущих от этих ядер в желатинозную субстанцию спинного мозга, приводит к активации тормозящих вставочных опиоидергических и ГАМКергических нейронов желатинозной субстанции, и к прерыванию или ослаблению болевого сигнала от первичных соматосенсорных и висцеросенсорных нейронов ко вторичным. Анальгетическое действие ГАМКергических препаратов, таких, как баклофен, реализуется ещё одним уровнем иерархии ниже — непосредственно на уровне ГАМКергических вставочных нейронов спинного мозга.
Роль в организации различных видов защитного поведения
Стимуляция дорсального и/или латеральных участков ОСВ вызывает у экспериментальных животных разных видов защитные реакции, варьирующиеся в диапазоне от замирания, прислушивания и принюхивания в напряжённой готовности к немедленному осуществлению реакции «бей или беги», до собственно убегания, прыжков или проявлений защитной агрессии вроде оскаливания зубов, выпускания когтей, взъерошивания шерсти. Все эти реакции сопровождаются также увеличением частоты дыхания и его глубины с развитием временного физиологического тахипноэ, повышением частоты сердечных сокращений с развитием временной физиологической тахикардии, повышением артериального давления с развитием временной физиологической артериальной гипертензии, повышением скорости метаболизма и температуры тела до субфебрильных цифр, повышением содержания глюкозы в крови с развитием временной физиологической гипергликемии, повышением мышечного тонуса. Эти физиологические сдвиги наступают раньше, чем животное побежит, прыгнет или само нападёт на потенциального агрессора, и необходимы для подготовки организма к эффективному осуществлению реакции «бей или беги» (усиленная прокачка крови к мышцам, улучшение их снабжения глюкозой и кислородом, и т. д.). Одновременно у экспериментального животного развивается сильная анальгезия, по-видимому, служащая для превентивной защиты от возможных последствий нападения хищника или от травм, полученных в процессе поспешного бегства.
Напротив, стимуляция каудального вентролатерального участка ОСВ вызывает у экспериментальных животных реакцию, известную как «притвориться мёртвым» — паралич взора при открытых глазах или закрывание глазных век, расширение зрачков, замирание в неподвижности, но, в противоположность первому типу реакции, с глубоким расслаблением мышц и принятием восковой гибкости (животное пассивно принимает любую придаваемую ему исследователем или хищником позу, но затем конечности якобы «мёртвого» животного или сами собой падают под действием силы тяжести, или же «застывают», имитируя трупное окоченение), максимально возможным замедлением метаболизма, снижением температуры тела до степени небольшой гипотермии, урежением дыхания и уменьшением его глубины с развитием брадипноэ, замедлением сердечных сокращений до степени небольшой брадикардии, снижением артериального давления с развитием некоторой гипотензии. Вся эта совокупность реакций направлена на то, чтобы потенциальный хищник (большинство из которых падаль не ест, предпочитая свежеубитую им самим жертву) с как можно меньшей вероятностью смог отличить притворившееся мёртвым животное от действительно мёртвого. Эта реакция тоже сопровождается развитием выраженной анальгезии, даже более сильной, чем в первом случае (что опять-таки повышает вероятность выживания и успешность «притворения мёртвым» в такой ситуации, в силу того, что хорошо анальгезированное животное с меньшей вероятностью подаст голос или шевельнётся, или задышит чаще, когда хищник станет его терзать, проверяя, действительно ли оно мертво).
Угнетение же активности каудального вентролатерального участка ОСВ, напротив, приводит к повышению у экспериментальных животных интереса к окружающему миру и исследовательской локомоторной (двигательной) активности.
Поражения или повреждения каудальной вентролатеральной части ОСВ приводят к значительному ослаблению или полному исчезновению условнорефлекторных замираний в ответ на условно неприятные стимулы (например, звук, за которым должен последовать удар током). Поражения или повреждения дорсальной или латеральных частей ОСВ значительно уменьшают агрессивность животных и их склонность проявлять врождённые неспецифические защитные реакции, такие, как оскаливание зубов, выпускание когтей, взъерошивание шерсти, а также их склонность убегать или прятаться.
Роль в регуляции копулятивного поведения
Нейроны околоводопроводного серого вещества получают входящую информацию от вентромедиального ядра гипоталамуса и играют роль в осуществлении копулятивного поведения, прежде всего у самок. Они обеспечивают принятие самкой позы покорности и подчинения, уменьшение её агрессивности, развитие лордоза («отклячивания зада», «приседания») у самки перед половым сношением, а также некоторую степень анальгезии для обоих партнёров в процессе сношения и некоторое время после него.
Роль в регуляции родительского и дружественного поведения
Околоводопроводное серое вещество вовлечено в регуляцию родительского (прежде всего материнского), семейного и дружественного поведения. В зоне ОСВ имеется очень высокая плотность рецепторов к пролактину, окситоцину и вазопрессину, а также клетки, секретирующие их. Эти важные нейропептиды принимают участие в регуляции родительского (особенно материнского), семейного и дружественного поведения, в формировании связей «родитель-ребёнок», партнёрских уз и дружеских связей, а также в формировании социальных связей более общего характера, и в регуляции уровня агрессивности по отношению к представителям своего вида. Кроме того, область ОСВ, богатая этими рецепторами, имеет тесные связи с орбитофронтальной корой. Влияние ОСВ на активность орбитофронтальной коры, собственно, и опосредует роль ОСВ в регуляции родительского, партнёрского и дружественного поведения. Латеральная орбитофронтальная кора активируется приятными зрительными, тактильными и обонятельными стимулами. При этом её активность зависит не от интенсивности стимула, а от восприятия того или иного стимула как приятного. Выделением окситоцина (в некоторых случаях, таких, как материнство или сексуальная активность, также выделением пролактина) в ОСВ, с последующим усилением активности латеральной орбитофронтальной коры в ответ на такие субъективно приятные стимулы, как внешний вид и запах тела или волос партнёра, внешний вид и запах тела ребёнка, тактильные ощущения от прикосновения к коже партнёра или ребёнка, или тактильные ощущения от дружеских объятий и рукопожатий (человеческого аналога взаимного «почёсывания шёрстки» у приматов) опосредуется быстрое возникновение родительской привязанности, привязанности к партнёру или другу[4].
Дополнительные изображения
 Схематическое изображение основных категорий базальных ядер (от I до V).
Схематическое изображение основных категорий базальных ядер (от I до V).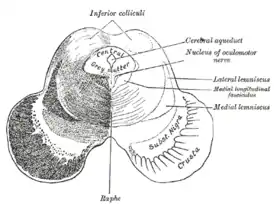
Примечания
- Central gray substance // Foundational Model of Anatomy
- Basbaum A. I., Fields H. L. Endogenous pain control mechanisms: review and hypothesis (англ.) // Ann. Neurol. : journal. — 1978. — November (vol. 4, no. 5). — P. 451—462. — doi:10.1002/ana.410040511. — PMID 216303.
- Jenkins, Dacher Keltner, Keith Oatley, Jennifer M. Understanding emotions (неопр.). — 3rd. — Hoboken, N.J.: Wiley. — ISBN 9781118147436.
- Andreas Bartels; Semir Zeki. The neural correlates of maternal and romantic love (англ.) // NeuroImage : journal. — 2004. — March (vol. 21, no. 3). — P. 1155—1166. — doi:10.1016/j.neuroimage.2003.11.003. — PMID 15006682. Архивировано 29 августа 2017 года.