Ментол
Ментол (от лат. Mentha — мята) — органическое вещество, важный вторичный метаболит растений семейства яснотковые, получают синтетически или выделяют из мятного эфирного масла. Прозрачное кристаллическое вещество, при комнатной температуре легко плавится. Существует 8 изомеров с довольно близкими свойствами. Основной природный изомер (-)-ментол (1R,2S,5R) конфигурация. Обладает слабыми местноанестизирующими свойствами, стимулирует холодовые рецепторы кожи и слизистых, слабый антисептик. Широко используется в пищевкусовой промышленности и в медицине. В частности, является основной составляющей рефлекторного сосудорасширяющего средства валидол.
| Ментол | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
(2S)-(2-пропил)-(5R)-метил-(1R)-циклогексанол | ||
| Традиционные названия | 3-p-ментанол, гексагидротимол, мятная камфора | ||
| Хим. формула | C10H20O | ||
| Физические свойства | |||
| Состояние | кристаллическое | ||
| Молярная масса | 156,27 г/моль | ||
| Плотность | 0,890 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления |
36-38 °C (311 K), рацемат 42-45 °C (318 K), (−)-форма (α) 35-33-31 °C, (−)-изомер |
||
| • кипения | 212 °C | ||
| • вспышки | 93 °C | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | малорастворим | ||
| • в этаноле, уксусной кислоте, гексане | растворим | ||
| • в эфире | растворим | ||
| • в ацетоне | растворим | ||
| • в хлороформе | растворим | ||
| Вращение | −50° | ||
| Классификация | |||
| Рег. номер CAS | 2216-51-5 | ||
| PubChem | 16666 | ||
| Рег. номер EINECS | 218-690-9 | ||
| SMILES | |||
| InChI | |||
| RTECS |
OT0350000, рацемат OT0700000, (−)-энантиомер |
||
| ChEBI | 15409 | ||
| ChemSpider | 15803 | ||
| Безопасность | |||
| Фразы риска (R) | R37/38, R41 | ||
| Фразы безопасности (S) | S26, S36 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
История
Есть свидетельства[1], что ментол был известен в Японии более 2000 лет назад, но на Западе нет данных о его выделении до 1771 года (Gambius)[3]. (-)-Ментол (также называемый l-ментол или (1R,2S,5R)-ментол) выделен из эфирного масла мяты (вместе с примесью ментона, ментилацетата и др. соединений), он может быть получен и из др. видов — Mentha piperita L. Неочищенный японский ментол содержит небольшое количество 1-эпи, (+)-неоментола.
Структура молекулы
В природе чаще всего встречается один (1R,2S,5R)-энантиомер (см. внизу слева на рис.). Остальные 7 стереоизомеров:
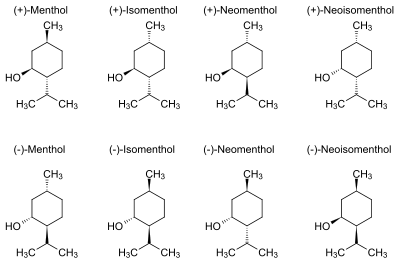
В соединениях природного происхождения изопропильная группа транс-ориентирована по отношению к метильной и спиртовой группе (см. рис.):
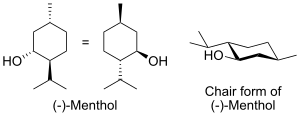
Все 3 объёмные группы в конформации «кресло» находятся в наиболее удалённых друг от друга экваториальных положениях, что делает (-)-ментол и его энантиомер — двумя наиболее стабильными изомерами из 8 возможных.
Существуют 2 кристаллические формы рацемического ментола с Тпл. 28 °C и 38 °C. Чистый (-)-ментол имеет 4 кристаллические формы, наиболее стабильна α форма.
Применение
Ментол используется в фармацевтических препаратах безрецептурной группы, предназначенных для лечения простуды, ревматизма, для снятия мышечных болей от усталости и пр. В ряде средств для ухода за полостью рта и в косметических средствах применяют натуральный или синтетический ментол, или мятные эфирные масла, например, в средствах от кашля и в зубной пасте. Охлаждающее действие ментола на кожные рецепторы позволяет снизить раздражение и зуд, например, при аллергии. Ментол добавляют в сигареты для снижения раздражения, вызываемого дымом в лёгких.
В пищевой промышленности ментол и мятное масло используются в качестве ароматизаторов карамели, спиртных напитков, кондитерских изделий (пряники).
Используется для синтеза ментиловых эфиров, например, ментилацетат используется в парфюмерии для создания цветочной ноты (особенно в композициях для имитации розы).
В органической химии хиральность ментола применяют в стереоспецифичном (асимметричном) синтезе. Ментол используют в классической методике разделения хиральных карбоновых кислот через образование ментиловых эфиров.
Получение
В Викиучебнике имеется материал по теме Получение ментола
Выделение из природного сырья
Для выделения ментола из эфирного масла мяты перечной предварительно проводят щелочное омыление содержащихся в нём сложных эфиров, а затем переводят ментол в эфир борной кислоты. Летучие компоненты масла отгоняют в вакууме, а оставшийся борный эфир гидролизуют карбонатом натрия и отгоняют ментол с водяным паром. Эфирное масло содержит 50—70 % ментола[1].
Синтез
Количество натурального ментола существенно уступает потребностям пищевой и фармацевтической промышленности.
M. производят преимущественно в энантиомерночистом виде (94 % е. е.). Промышленный синтез включает в себя стадию асимметрического гидрирования, разработанную Рёдзи Ноёри с сотрудниками (Нобелевская премия по химии в 2001 году).
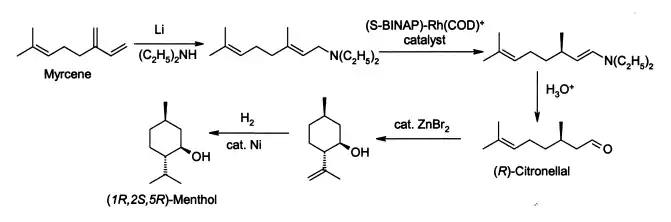
Рацемический Ментол может быть получен гидрированием тимола или пулегона. Для получения др. изомеров (неоментол и др.), см. Лит. 1.
Идентификация
Обнаружить ментол можно при помощи цветной реакции: водные растворы его с 1 % раствором ванилина и концентрированной серной кислотой дают устойчивую фиолетово-синюю окраску. Для идентификации по температуре плавления производных получают фенилуретан и α-нафтилуретан реакцией с избытком соответствующего изоцианата в петролейном эфире. Температура плавления фенилуретана (-)-ментола 112 °C, α-нафтилуретана (-)-ментола 120 °C[1].
Химические свойства
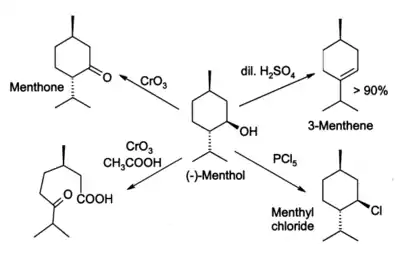
Многообразие реакций ментола обусловлено его строением вторичного спирта. Ментол окисляется до ментона хромовой кислотой, хотя при определённых условиях окисление может быть доведено до разрыва кольца. Ментол легко дегидрируется, преимущественно в 3-ментен под действием 2%-ной серной кислоты. PCl5 переводит ментол в ментилхлорид.
Примечания
- Г. В. Лазурьевский, И. В. Терентьева, А. А. Шамшурин. Практические работы по химии природных соединений. Выпуск I. Методы выделения, разделения и идентификации. — М.: «Высшая школа», 1961. — С. 90—92.
Литература
- J. L. Simonsen, The Terpenes Volume I (2nd edition), Cambridge University Press, 1947, p. 230-249.
- E. E. Turner, M. M. Harris, Organic Chemistry, Longmans, Green & Co., London, 1952.
- Adversoriorum varii argumentii, Liber unus, Leiden, 1771, p. 99.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
-Menthol.svg.png.webp)
-menthol-3D-vdW.png.webp)
