Каспаза 3
Каспаза 3 (англ. Caspase 3, сокр. CASP3) — протеолитический фермент, одна из каспаз человека, взаимодействует с каспазой-8 и каспазой-9. Кодируется одноимённым геном CASP3, который локализован на коротком плече (p-плече) 4-ой хромосомы. Ортологи CASP3 были идентифицированы у многих видов млекопитающих, для которых имеются полные данные генома. Уникальные ортологи также присутствуют у птиц, ящериц, лиссамфибий и телеостов. Длина полипептидной цепи белка составляет 277 аминокислотных остатков, а молекулярная масса — 31608 Да[1].
Белок CASP3 является членом семейства цистеиновых протеаз, расщепляющих белки исключительно после аспартата[2]. Последовательная активация каспаз играет центральную роль в фазе исполнения клеточного апоптоза. Каспазы существуют в виде неактивных проферментов, которые подвергаются протеолитической обработке в консервативных аспарагиновых остатках с образованием двух субъединиц, больших и малых, которые димеризуются с образованием активного фермента. Димеризованный белок расщепляет и активирует каспазы 6 и 7; и сам белок модифицируется и активируется каспазами 8, 9 и 10. Каспаза 3 является преобладающей каспазой, участвующей в расщеплении белка-предшественника амилоид-бета 4А, который связан с нейрональной смертью, происходящей при болезни Альцгеймера[3]. Альтернативный сплайсинг этого гена приводит к двум вариантам транскрипта, которые кодируют один и тот же белок[4].
 Сигнальный путь TNF-R1. Пунктирные серые линии представляют несколько ступеней. |
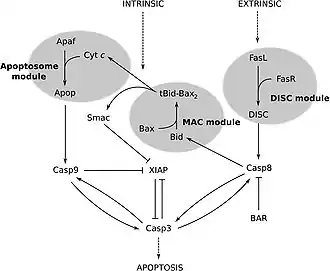 Пути, ведущие к активации каспазы 3[5]. |
Каспаза 3 обладает многими типичными характеристиками, общими для всех известных в настоящее время каспаз. Например, его активный сайт содержит остаток цистеина (Cys-163) и остаток гистидина (His-121), которые стабилизируют расщепление пептидной связи в молекуле белка на С-терминальной стороне аспарагиновой кислоты, когда она является частью специфической 4-аминокислотной последовательностью[6][7]. Эта специфичность позволяет каспазам быть невероятно селективными, с 20000-кратным предпочтением аспарагиновой кислоты по сравнению с глутаминовой кислотой[8]. Ключевой особенностью каспаз в клетке является то, что они присутствуют в виде предшественников (зимогенов), называемых прокаспазами, которые неактивны до тех пор, пока биохимические изменения не вызывают их активацию. Каждая прокаспаза имеет N-концевую большую субъединицу с молекулярной массой около 20 кДа, за которой следует меньшая субъединица с массой около 10 кДа, называемые p20 и p10 соответственно[9].
Субстратная специфичность
В нормальных условиях каспазы распознают тетрапептидные последовательности на своих субстратах и гидролизуют пептидные связи, расположенные после остатков аспарагиновой кислоты. Каспаза 3 и каспаза 7 обладают сходной субстратной специфичностью, распознавая тетрапептидный мотив Asp-x-x-Asp[10]. C-конец аспартата (Asp) имеет абсолютную необходимость, в то время как в других трёх положениях могут быть допущены некоторые изменения[11]. Специфичность к каспазному субстрату широко используется в ингибиторах на основе данных ферментов и разработке лекарственных препаратов[12].
Структура
Каспаза 3 (также известная как CPP32 /Yama/apopain)[13][14][15] образуется из профермента (зимогена) с молекулярной массой 32 кДа, который расщепляется на две субъединицы, с молекулярными массами соответственно 17 кДа и 12 кДа. Когда прокаспаза расщепляется по определённому остатку, активный гетеротетрамер может быть затем образован гидрофобными взаимодействиями, в результате чего четыре антипараллельных бета-листа из p17 и два из p12 соединяются вместе, образуя гетеродимер, который, в свою очередь, взаимодействует с другим гетеродимером, формируя полную 12-элементную структуру бета-листа, окруженную альфа-спиралями, которые являются уникальными для каспаз[9][16] . Когда гетеродимеры совмещаются друг с другом по типу голова-хвост (head-to-tail), активный сайт располагается на каждом конце молекулы, образованной остатками обеих участвующих субъединиц, хотя необходимые аминокислотные остатки Cys-163 и His-121 находятся на p17 (большой) субъединице[16].

Механизм катализа
Каталитический сайт каспазы 3 включает сульфогидрильную группу аминокислотного остатка Cys-163 и имидазольное кольцо His-121. Остаток His-121 стабилизирует карбонильную группу ключевого остатка аспартата, в то время как Cys-163 атакует, в конечном счете, разрывая пептидную связь. Остатки Cys-163 и Gly-238 также функционируют для стабилизации тетраэдрического переходного состояния комплекса субстрат-фермент посредством водородной связи[16]. In vitro было обнаружено, что каспаза 3 предпочитает пептидную последовательность DEVDG (Asp-Glu-Val-Asp-Gly) с расщеплением, происходящим на карбоксильном конце второго остатка аспарагиновой кислоты (между D и G)[8][16][17]. Каспаза 3 активна в широком диапазоне рН, который несколько выше (более основный), чем у многих других каспаз-эффекторов. Данный широкий диапазон указывает на то, что каспаза 3 может быть полностью активна в нормальных и апоптотических условиях[18].
Активация
Каспаза 3 активируется в апоптотической клетке как внешним (лигандами смерти), так и внутренним (митохондриальным) путями[9][19]. Отличительной чертой зимогена каспазы 3 является необходимая регуляция, потому что если он не регулируется, активность каспазы приводит к тотальной смерти всех клеток (как здоровых, так и патологических)[20]. Как каспаза-эффектор (экзекутор), зимоген каспазы-3 практически не обладает активностью, пока не происходит его расщепления посредством инициаторной каспазы после того, как произошла передача апоптотического сигнала[21]. Одним из таких сигнальных событий является введение гранзима B цитотоксическими Т-лимфоцитами внутрь клеток, который может активировать инициаторную каспазу[22][23]. Данная внешняя активация затем запускает характерный для апоптотического пути каспазный каскад, в котором каспаза 3 играет доминирующую роль[7] . При внутренней активации каспазы молекулы цитохрома С из митохондрий работают в комбинации с каспазой 9, апоптоз-активирующим фактором 1 (сокр. APAF1), и АТФ необходимой для прокаспазы 3[17][23][24]. Этих молекул достаточно для активации каспазы 3 in vitro, но in vivo необходимы другие регуляторные белки[24]. Было показано, что экстракт мангостана (Garcinia mangostana) ингибирует активацию каспазы 3 в нейрональных клетках человека, обработанных В-амилоидом[25].
Ингибирование
Одним из способов ингибирования каспазы является использование семейства белков IAP (ингибиторов апоптоза), которое включает c-IAP1, c-IAP2, XIAP и ML-IAP[16]. XIAP связывает и ингибирует инициатор каспазы 9, который непосредственно участвует в активации расщепителя каспазы 3[24]. Однако во время каспазного каскада каспаза 3 ингибирует активность XIAP путём расщепления каспазы 9 на конкретном сайте, предотвращая способность связывания XIAP и тем самым ингибировать активность каспазы 9[26].
Биологические функции
Было обнаружено, что каспаза 3 необходима для нормального развития мозга, а также для её типичной роли в процессоре апоптоза, где она отвечает за конденсацию хроматина и фрагментацию ДНК[17]. Повышенные уровни p17 (малых) субъединиц каспазы 3, в кровотоке являются признаком недавнего инфаркта миокарда[27]. В настоящее время показано, что каспаза 3 может играть роль в дифференцировке эмбриональных и гемопоэтических стволовых клеток[28].
Взаимодействие с другими белками
Было показано, что каспаза 3 взаимодействует со следующими белками:
Примечания
- UniProt, P42574 (англ.) ?. Дата обращения: 14 октября 2019.
- Alnemri E. S., Livingston D. J., Nicholson D. W., Salvesen G., Thornberry N. A., Wong W. W., Yuan J. Human ICE/CED-3 protease nomenclature (англ.) // Cell. — Cell Press, 1996. — October (vol. 87, no. 2). — P. 171. — doi:10.1016/S0092-8674(00)81334-3. — PMID 8861900.
- Gervais F. G., Xu D., Robertson G. S., Vaillancourt J. P., Zhu Y., Huang J., LeBlanc A., Smith D., Rigby M., Shearman M. S., Clarke E. E., Zheng H., Van Der Ploeg L. H., Ruffolo S. C., Thornberry N. A., Xanthoudakis S., Zamboni R. J., Roy S., Nicholson D. W. Involvement of caspases in proteolytic cleavage of Alzheimer's amyloid-beta precursor protein and amyloidogenic A beta peptide formation (англ.) // Cell : journal. — Cell Press, 1999. — April (vol. 97, no. 3). — P. 395—406. — doi:10.1016/s0092-8674(00)80748-5. — PMID 10319819.
- Entrez Gene: CASP3 caspase 3, apoptosis-related cysteine peptidase.
- Harrington H. A., Ho K. L., Ghosh S., Tung K. C. Construction and analysis of a modular model of caspase activation in apoptosis (англ.) // Theoretical Biology & Medical Modelling : journal. — 2008. — Vol. 5, no. 1. — P. 26. — doi:10.1186/1742-4682-5-26. — PMID 19077196.
- Wyllie A. H. Apoptosis: an overview (англ.) // British Medical Bulletin : journal. — 1997. — Vol. 53, no. 3. — P. 451—465. — doi:10.1093/oxfordjournals.bmb.a011623. — PMID 9374030.
- Perry D. K., Smyth M. J., Stennicke H. R., Salvesen G. S., Duriez P., Poirier G. G., Hannun Y. A. Zinc is a potent inhibitor of the apoptotic protease, caspase-3. A novel target for zinc in the inhibition of apoptosis (англ.) // The Journal of Biological Chemistry : journal. — 1997. — July (vol. 272, no. 30). — P. 18530—18533. — doi:10.1074/jbc.272.30.18530. — PMID 9228015.
- Stennicke H. R., Renatus M., Meldal M., Salvesen G. S. Internally quenched fluorescent peptide substrates disclose the subsite preferences of human caspases 1, 3, 6, 7 and 8 (англ.) // The Biochemical Journal : journal. — 2000. — September (vol. 350, no. 2). — P. 563—568. — doi:10.1042/0264-6021:3500563. — PMID 10947972.
- Salvesen G. S. Caspases: opening the boxes and interpreting the arrows (англ.) // Cell Death and Differentiation : journal. — 2002. — January (vol. 9, no. 1). — P. 3—5. — doi:10.1038/sj.cdd.4400963. — PMID 11803369.
- Agniswamy J., Fang B., Weber I. T. Plasticity of S2-S4 specificity pockets of executioner caspase-7 revealed by structural and kinetic analysis (англ.) // The FEBS Journal : journal. — 2007. — September (vol. 274, no. 18). — P. 4752—4765. — doi:10.1111/j.1742-4658.2007.05994.x. — PMID 17697120.
- Fang B., Boross P. I., Tozser J., Weber I. T. Structural and kinetic analysis of caspase-3 reveals role for s5 binding site in substrate recognition (англ.) // Journal of Molecular Biology : journal. — 2006. — July (vol. 360, no. 3). — P. 654—666. — doi:10.1016/j.jmb.2006.05.041. — PMID 16781734.
- Weber I. T., Fang B., Agniswamy J. Caspases: structure-guided design of drugs to control cell death (англ.) // Mini Reviews in Medicinal Chemistry : journal. — 2008. — October (vol. 8, no. 11). — P. 1154—1162. — doi:10.2174/138955708785909899. — PMID 18855730.
- Fernandes-Alnemri T., Litwack G., Alnemri E. S. CPP32, a novel human apoptotic protein with homology to Caenorhabditis elegans cell death protein Ced-3 and mammalian interleukin-1 beta-converting enzyme (англ.) // The Journal of Biological Chemistry : journal. — 1994. — December (vol. 269, no. 49). — P. 30761—30764. — PMID 7983002.
- Tewari M., Quan L. T., O'Rourke K., Desnoyers S., Zeng Z., Beidler D. R., Poirier G. G., Salvesen G. S., Dixit V. M. Yama/CPP32 beta, a mammalian homolog of CED-3, is a CrmA-inhibitable protease that cleaves the death substrate poly(ADP-ribose) polymerase (англ.) // Cell : journal. — Cell Press, 1995. — June (vol. 81, no. 5). — P. 801—809. — doi:10.1016/0092-8674(95)90541-3. — PMID 7774019.
- Nicholson D. W., Ali A., Thornberry N. A., Vaillancourt J. P., Ding C. K., Gallant M., Gareau Y., Griffin P. R., Labelle M., Lazebnik Y. A. Identification and inhibition of the ICE/CED-3 protease necessary for mammalian apoptosis (англ.) // Nature : journal. — 1995. — July (vol. 376, no. 6535). — P. 37—43. — doi:10.1038/376037a0. — PMID 7596430.
- Lavrik I. N., Golks A., Krammer P. H. Caspases: pharmacological manipulation of cell death (англ.) // The Journal of Clinical Investigation : journal. — 2005. — October (vol. 115, no. 10). — P. 2665—2672. — doi:10.1172/JCI26252. — PMID 16200200.
- Porter A. G., Jänicke R. U. Emerging roles of caspase-3 in apoptosis (англ.) // Cell Death and Differentiation : journal. — 1999. — February (vol. 6, no. 2). — P. 99—104. — doi:10.1038/sj.cdd.4400476. — PMID 10200555.
- Stennicke H. R., Salvesen G. S. Biochemical characteristics of caspases-3, -6, -7, and -8 (англ.) // The Journal of Biological Chemistry : journal. — 1997. — October (vol. 272, no. 41). — P. 25719—25723. — doi:10.1074/jbc.272.41.25719. — PMID 9325297.
- Ghavami S., Hashemi M., Ande S. R., Yeganeh B., Xiao W., Eshraghi M., Bus C. J., Kadkhoda K., Wiechec E., Halayko A. J., Los M. Apoptosis and cancer: mutations within caspase genes (англ.) // Journal of Medical Genetics : journal. — 2009. — August (vol. 46, no. 8). — P. 497—510. — doi:10.1136/jmg.2009.066944. — PMID 19505876.
- Boatright K. M., Salvesen G. S. Mechanisms of caspase activation (англ.) // Current Opinion in Cell Biology. — Elsevier, 2003. — December (vol. 15, no. 6). — P. 725—731. — doi:10.1016/j.ceb.2003.10.009. — PMID 14644197.
- Walters J., Pop C., Scott F. L., Drag M., Swartz P., Mattos C., Salvesen G. S., Clark A. C. A constitutively active and uninhibitable caspase-3 zymogen efficiently induces apoptosis (англ.) // The Biochemical Journal : journal. — 2009. — December (vol. 424, no. 3). — P. 335—345. — doi:10.1042/BJ20090825. — PMID 19788411.
- Gallaher B. W., Hille R., Raile K., Kiess W. Apoptosis: live or die--hard work either way! (неопр.) // Hormone and Metabolic Research. — 2001. — September (т. 33, № 9). — С. 511—519. — doi:10.1055/s-2001-17213. — PMID 11561209.
- Katunuma N., Matsui A., Le Q. T., Utsumi K., Salvesen G., Ohashi A. Novel procaspase-3 activating cascade mediated by lysoapoptases and its biological significances in apoptosis (англ.) // Advances in Enzyme Regulation : journal. — 2001. — Vol. 41, no. 1. — P. 237—250. — doi:10.1016/S0065-2571(00)00018-2. — PMID 11384748.
- Li P., Nijhawan D., Wang X. Mitochondrial activation of apoptosis (англ.) // Cell. — Cell Press, 2004. — January (vol. 116, no. 2 Suppl). — P. S57—9, 2 p following S59. — doi:10.1016/S0092-8674(04)00031-5. — PMID 15055583.
- Moongkarndi P., Srisawat C., Saetun P., Jantaravinid J., Peerapittayamongkol C., Soi-ampornkul R., Junnu S., Sinchaikul S., Chen S. T., Charoensilp P., Thongboonkerd V., Neungton N. Protective effect of mangosteen extract against beta-amyloid-induced cytotoxicity, oxidative stress and altered proteome in SK-N-SH cells (англ.) // Journal of Proteome Research : journal. — 2010. — May (vol. 9, no. 5). — P. 2076—2086. — doi:10.1021/pr100049v. — PMID 20232907.
- Denault J. B., Eckelman B. P., Shin H., Pop C., Salvesen G. S. Caspase 3 attenuates XIAP (X-linked inhibitor of apoptosis protein)-mediated inhibition of caspase 9 (англ.) // The Biochemical Journal : journal. — 2007. — July (vol. 405, no. 1). — P. 11—9. — doi:10.1042/BJ20070288. — PMID 17437405.
- Agosto M., Azrin M., Singh K., Jaffe A. S., Liang B. T. Serum caspase-3 p17 fragment is elevated in patients with ST-segment elevation myocardial infarction: a novel observation (англ.) // Journal of the American College of Cardiology : journal. — 2011. — January (vol. 57, no. 2). — P. 220—221. — doi:10.1016/j.jacc.2010.08.628. — PMID 21211695.
- Abdul-Ghani M., Megeney L. A. Rehabilitation of a contract killer: caspase-3 directs stem cell differentiation (англ.) // Cell Stem Cell : journal. — 2008. — June (vol. 2, no. 6). — P. 515—516. — doi:10.1016/j.stem.2008.05.013. — PMID 18522841.
- Guo Y., Srinivasula S. M., Druilhe A., Fernandes-Alnemri T., Alnemri E. S. Caspase-2 induces apoptosis by releasing proapoptotic proteins from mitochondria (англ.) // The Journal of Biological Chemistry : journal. — 2002. — April (vol. 277, no. 16). — P. 13430—13437. — doi:10.1074/jbc.M108029200. — PMID 11832478.
- Srinivasula S. M., Ahmad M., Fernandes-Alnemri T., Litwack G., Alnemri E. S. Molecular ordering of the Fas-apoptotic pathway: the Fas/APO-1 protease Mch5 is a CrmA-inhibitable protease that activates multiple Ced-3/ICE-like cysteine proteases (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1996. — December (vol. 93, no. 25). — P. 14486—14491. — doi:10.1073/pnas.93.25.14486. — PMID 8962078.
- Selvakumar, P.; Sharma, RK. Role of calpain and caspase system in the regulation of N-myristoyltransferase in human colon cancer (Review). (англ.) // Int J Mol Med : journal. — 2007. — May (vol. 19, no. 5). — P. 823—827. — doi:10.3892/ijmm.19.5.823. — PMID 17390089.
- Shu H. B., Halpin D. R., Goeddel D. V. Casper is a FADD- and caspase-related inducer of apoptosis (англ.) // Immunity : journal. — Cell Press, 1997. — June (vol. 6, no. 6). — P. 751—763. — doi:10.1016/S1074-7613(00)80450-1. — PMID 9208847.
- Han D. K., Chaudhary P. M., Wright M. E., Friedman C., Trask B. J., Riedel R. T., Baskin D. G., Schwartz S. M., Hood L. MRIT, a novel death-effector domain-containing protein, interacts with caspases and BclXL and initiates cell death (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1997. — October (vol. 94, no. 21). — P. 11333—11338. — doi:10.1073/pnas.94.21.11333. — PMID 9326610.
- Forcet C., Ye X., Granger L., Corset V., Shin H., Bredesen D. E., Mehlen P. The dependence receptor DCC (deleted in colorectal cancer) defines an alternative mechanism for caspase activation (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2001. — March (vol. 98, no. 6). — P. 3416—3421. — doi:10.1073/pnas.051378298. — PMID 11248093.
- Samali A., Cai J., Zhivotovsky B., Jones D. P., Orrenius S. Presence of a pre-apoptotic complex of pro-caspase-3, Hsp60 and Hsp10 in the mitochondrial fraction of jurkat cells (англ.) // The EMBO Journal : journal. — 1999. — April (vol. 18, no. 8). — P. 2040—2048. — doi:10.1093/emboj/18.8.2040. — PMID 10205158.
- Xanthoudakis S., Roy S., Rasper D., Hennessey T., Aubin Y., Cassady R., Tawa P., Ruel R., Rosen A., Nicholson D. W. Hsp60 accelerates the maturation of pro-caspase-3 by upstream activator proteases during apoptosis (англ.) // The EMBO Journal : journal. — 1999. — April (vol. 18, no. 8). — P. 2049—2056. — doi:10.1093/emboj/18.8.2049. — PMID 10205159.
- Ruzzene M., Penzo D., Pinna L. A. Protein kinase CK2 inhibitor 4,5,6,7-tetrabromobenzotriazole (TBB) induces apoptosis and caspase-dependent degradation of haematopoietic lineage cell-specific protein 1 (HS1) in Jurkat cells (англ.) // The Biochemical Journal : journal. — 2002. — May (vol. 364, no. Pt 1). — P. 41—7. — doi:10.1042/bj3640041. — PMID 11988074.
- Chen Y. R., Kori R., John B., Tan T. H. Caspase-mediated cleavage of actin-binding and SH3-domain-containing proteins cortactin, HS1, and HIP-55 during apoptosis (англ.) // Biochemical and Biophysical Research Communications : journal. — 2001. — November (vol. 288, no. 4). — P. 981—989. — doi:10.1006/bbrc.2001.5862. — PMID 11689006.
- Tamm I., Wang Y., Sausville E., Scudiero D. A., Vigna N., Oltersdorf T., Reed J. C. IAP-family protein survivin inhibits caspase activity and apoptosis induced by Fas (CD95), Bax, caspases, and anticancer drugs (англ.) // Cancer Research : journal. — American Association for Cancer Research, 1998. — December (vol. 58, no. 23). — P. 5315—5320. — PMID 9850056.
- Shin S., Sung B. J., Cho Y. S., Kim H. J., Ha N. C., Hwang J. I., Chung C. W., Jung Y. K., Oh B. H. An anti-apoptotic protein human survivin is a direct inhibitor of caspase-3 and -7 (англ.) // Biochemistry : journal. — 2001. — January (vol. 40, no. 4). — P. 1117—1123. — doi:10.1021/bi001603q. — PMID 11170436.
- Lee Z. H., Lee S. E., Kwack K., Yeo W., Lee T. H., Bae S. S., Suh P. G., Kim H. H. Caspase-mediated cleavage of TRAF3 in FasL-stimulated Jurkat-T cells (англ.) // Journal of Leukocyte Biology : journal. — 2001. — March (vol. 69, no. 3). — P. 490—496. — PMID 11261798.
- Leo E., Deveraux Q. L., Buchholtz C., Welsh K., Matsuzawa S., Stennicke H. R., Salvesen G. S., Reed J. C. TRAF1 is a substrate of caspases activated during tumor necrosis factor receptor-alpha-induced apoptosis (англ.) // The Journal of Biological Chemistry : journal. — 2001. — March (vol. 276, no. 11). — P. 8087—8093. — doi:10.1074/jbc.M009450200. — PMID 11098060.
- Suzuki Y., Nakabayashi Y., Takahashi R. Ubiquitin-protein ligase activity of X-linked inhibitor of apoptosis protein promotes proteasomal degradation of caspase-3 and enhances its anti-apoptotic effect in Fas-induced cell death (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2001. — July (vol. 98, no. 15). — P. 8662—8667. — doi:10.1073/pnas.161506698. — PMID 11447297.
- Silke J., Hawkins C. J., Ekert P. G., Chew J., Day C. L., Pakusch M., Verhagen A. M., Vaux D. L. The anti-apoptotic activity of XIAP is retained upon mutation of both the caspase 3- and caspase 9-interacting sites (англ.) // The Journal of Cell Biology : journal. — 2002. — April (vol. 157, no. 1). — P. 115—124. — doi:10.1083/jcb.200108085. — PMID 11927604.
- Riedl S. J., Renatus M., Schwarzenbacher R., Zhou Q., Sun C., Fesik S. W., Liddington R. C., Salvesen G. S. Structural basis for the inhibition of caspase-3 by XIAP (англ.) // Cell : journal. — Cell Press, 2001. — March (vol. 104, no. 5). — P. 791—800. — doi:10.1016/S0092-8674(01)00274-4. — PMID 11257232.
- Roy N., Deveraux Q. L., Takahashi R., Salvesen G. S., Reed J. C. The c-IAP-1 and c-IAP-2 proteins are direct inhibitors of specific caspases (англ.) // The EMBO Journal : journal. — 1997. — December (vol. 16, no. 23). — P. 6914—6925. — doi:10.1093/emboj/16.23.6914. — PMID 9384571.
- Deveraux Q. L., Takahashi R., Salvesen G. S., Reed J. C. X-linked IAP is a direct inhibitor of cell-death proteases (англ.) // Nature : journal. — 1997. — July (vol. 388, no. 6639). — P. 300—304. — doi:10.1038/40901. — PMID 9230442.
- Suzuki Y., Nakabayashi Y., Nakata K., Reed J. C., Takahashi R. X-linked inhibitor of apoptosis protein (XIAP) inhibits caspase-3 and -7 in distinct modes (англ.) // The Journal of Biological Chemistry : journal. — 2001. — July (vol. 276, no. 29). — P. 27058—27063. — doi:10.1074/jbc.M102415200. — PMID 11359776.
- Ohtsubo T., Kamada S., Mikami T., Murakami H., Tsujimoto Y. Identification of NRF2, a member of the NF-E2 family of transcription factors, as a substrate for caspase-3(-like) proteases (англ.) // Cell Death and Differentiation : journal. — 1999. — September (vol. 6, no. 9). — P. 865—872. — doi:10.1038/sj.cdd.4400566. — PMID 10510468.

