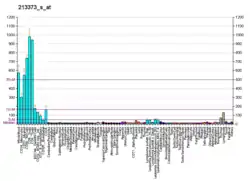
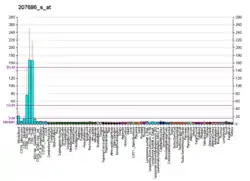
Каспаза 8
Каспаза 8 (англ. Caspase 8, сокр. CASP8) — протеолитический фермент, одна из каспаз, кодируется одноимённым геном CASP8, который у человека локализован на коротком плече (p-плече) 2-ой хромосомы. Скорее всего, действует на каспазу 3. Ортологи CASP8[1] были идентифицированы у многочисленных видов млекопитающих, для которых имеются полные данные генома. Эти уникальные ортологи также присутствуют у птиц.
Длина полипептидной цепи белка составляет 479 аминокислотных остатков, а молекулярная масса — 55 391 Да[2].
Функции
Ген CASP8 кодирует белок семейства цистеин-аспарагиновой кислоты протеазы (каспазы). Последовательная активация каспаз играет центральную роль в фазе выполнения клеточного апоптоза. Каспазы существуют в виде неактивных проферментов, состоящих из продомена, большой субъединицы протеазы и небольшой субъединицы. Активация каспаз требует протеолитического процессинга на консервативных внутренних аспарагиновых остатках для генерации гетеродимерного фермента, состоящего из больших и малых субъединиц. Этот белок участвует в запрограммированной гибели клеток, вызванного активацией Fas-рецептора и различными апоптотическими стимулами. Предполагается что N-концевой FADD-подобный эффекторный домен смерти этого белка может взаимодействовать с Fas-взаимодействующим белком FADD. Этот белок был обнаружен в нерастворимой фракции пораженной области мозга у пациентов с болезнью Хантингтона, но не у пациентов с нормальным контролем, что указывает на роль в нейродегенеративных заболеваниях. Было описано много альтернативно сплайсированных вариантов транскрипта, кодирующих разные изоформы, хотя не у всех вариантов были определены их полноразмерные последовательности[3].
Клиническое значение
Очень редкие генетические нарушения иммунной системы могут быть вызваны мутациями в этом гене. Данное заболевание, называемое CEDS (сокр. от Caspase eight deficiency state), расшифровывается как «состояние дефицита каспазы восемь». CEDS имеет признаки, сходные с ALPS (Аутоиммунный лимфопролиферативный синдром), ещё одним генетическим заболеванием апоптоза, с добавлением иммунодефицитного фенотипа. Таким образом, клинические проявления включают спленомегалию и лимфаденопатию, в дополнение к рецидивирующим синопульмональным инфекциям, рецидивирующей слизисто-герпесвирусной инфекции, персистирующим бородавкам, контагиозному моллюску и гипогаммаглобулинемии. Иногда в паренхиматозных органах наблюдается лимфоцитарное инфильтративное заболевание, но аутоиммунитет минимален, и у пациентов с CEDS не наблюдается лимфом. CEDS наследуется по аутосомно-рецессивному типу[4].
Клинический фенотип пациентов с CEDS представлял собой парадокс, поскольку каспаза 8 считалась главным образом проапоптотической протеазой, которая в основном участвовала в передаче сигнала от рецепторов смерти семейства рецепторов фактора некроза опухолей, таких как Fas. Дефект активации лимфоцитов и защитного иммунитета позволяет предположить, что каспаза 8 выполняет дополнительные сигнальные функции в лимфоцитах. Дальнейшая работа показала, что каспаза 8 необходима для индукции транскрипционного фактора «ядерного фактора κB» (NF-κB) после стимуляции через антигенные рецепторы, Fc-рецепторы или Toll-подобные рецепторы 4 в T, B-лимфоцитах и NK-клетках[4].
Биохимическими методами было обнаружено, что каспаза 8 входит в комплекс ингибитора киназы NF-κB (IKK) с восходящим адапторным комплексом Bcl10-MALT1 (слизистая оболочка лимфатической ткани), это имеет решающее значение для индукции ядерной транслокации NF-κB. Более того, биохимическая форма каспазы 8 различалась по двум путям. Для пути смерти зимоген каспазы 8 расщепляется на субъединицы, которые собираются для формирования зрелого высокоактивного гетеротетрамера каспазы, тогда как для пути активации зимоген, по-видимому, остается интактным, возможно, для ограничения его протеолитической функции, но усиливается его способность в качестве адапторного белка[4].
Взаимодействие
Каспаза 8 взаимодействует со следующими белками:
- BCAP31,[5]
- BID,[6][7]
- Bcl-2,[7][8]
- CFLAR,[9][10][11][12][13][14][15]
- Каспаза 10,[6][7][9][16]
- Каспаза 2,[7][16]
- Каспаза 3,[7][16]
- Каспаза 6,[7][16][17]
- Каспаза 7,[7][16]
- Каспаза 9,[7][16]
- DEDD,[18][19][20]
- FADD,[6][9][12][21][22][23][24]
- FasL,[6][9]
- FasR,[6][10][25]
- IFT57,[26]
- NOL3,[27]
- PEA15,[28][29]
- RIPK1,[21][30][31]
- TNFRSF10B,[6][25] и
- TRAF1.[9][32]
Метаболические карты
 Сигнальный путь TNF-R1. Пунктирные серые линии представляют несколько ступеней. 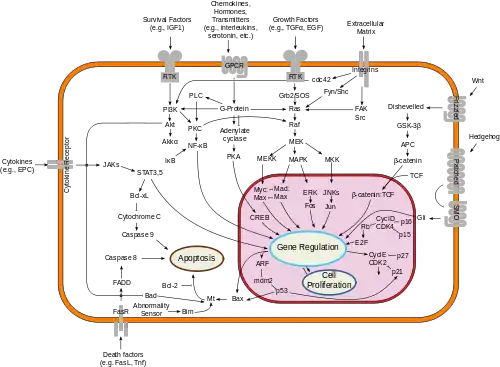 Обзор путей трансдукции сигналов, участвующих в апоптозе. |
Примечания
- OrthoMaM phylogenetic marker: CASP8 coding sequence. (недоступная ссылка)
- UniProt, Q14790 (англ.) ?. Дата обращения: 19 октября 2019.
- Entrez Gene: CASP8 caspase 8, apoptosis-related cysteine peptidase.
- Chun H. J., Zheng L., Ahmad M., Wang J., Speirs C. K., Siegel R. M., Dale J. K., Puck J., Davis J., Hall C. G., Skoda-Smith S., Atkinson T. P., Straus S. E., Lenardo M. J. Pleiotropic defects in lymphocyte activation caused by caspase-8 mutations lead to human immunodeficiency (англ.) // Nature : journal. — 2002. — Vol. 419, no. 6905. — P. 395—399. — doi:10.1038/nature01063. — PMID 12353035.
- Ng F. W., Nguyen M., Kwan T., Branton P. E., Nicholson D. W., Cromlish J. A., Shore G. C. p28 Bap31, a Bcl-2/Bcl-XL- and procaspase-8-associated protein in the endoplasmic reticulum (англ.) // J. Cell Biol. : journal. — 1997. — October (vol. 139, no. 2). — P. 327—338. — doi:10.1083/jcb.139.2.327. — PMID 9334338.
- Gajate C., Mollinedo F. Cytoskeleton-mediated death receptor and ligand concentration in lipid rafts forms apoptosis-promoting clusters in cancer chemotherapy (англ.) // J. Biol. Chem. : journal. — 2005. — March (vol. 280, no. 12). — P. 11641—11647. — doi:10.1074/jbc.M411781200. — PMID 15659383.
- Guo Y., Srinivasula S. M., Druilhe A., Fernandes-Alnemri T., Alnemri E. S. Caspase-2 induces apoptosis by releasing proapoptotic proteins from mitochondria (англ.) // J. Biol. Chem. : journal. — 2002. — April (vol. 277, no. 16). — P. 13430—13437. — doi:10.1074/jbc.M108029200. — PMID 11832478.
- Poulaki V., Mitsiades N., Romero M. E., Tsokos M. Fas-mediated apoptosis in neuroblastoma requires mitochondrial activation and is inhibited by FLICE inhibitor protein and Bcl-2 (англ.) // Cancer Research : journal. — American Association for Cancer Research, 2001. — June (vol. 61, no. 12). — P. 4864—4872. — PMID 11406564.
- Micheau O., Tschopp J. Induction of TNF receptor I-mediated apoptosis via two sequential signaling complexes (англ.) // Cell : journal. — Cell Press, 2003. — July (vol. 114, no. 2). — P. 181—190. — doi:10.1016/s0092-8674(03)00521-x. — PMID 12887920.
- Shu H. B., Halpin D. R., Goeddel D. V. Casper is a FADD- and caspase-related inducer of apoptosis (англ.) // Immunity : journal. — Cell Press, 1997. — June (vol. 6, no. 6). — P. 751—763. — doi:10.1016/s1074-7613(00)80450-1. — PMID 9208847.
- Goltsev Y. V., Kovalenko A. V., Arnold E., Varfolomeev E. E., Brodianskii V. M., Wallach D. CASH, a novel caspase homologue with death effector domains (англ.) // J. Biol. Chem. : journal. — 1997. — August (vol. 272, no. 32). — P. 19641—19644. — doi:10.1074/jbc.272.32.19641. — PMID 9289491.
- Srinivasula S. M., Ahmad M., Ottilie S., Bullrich F., Banks S., Wang Y., Fernandes-Alnemri T., Croce C. M., Litwack G., Tomaselli K. J., Armstrong R. C., Alnemri E. S. FLAME-1, a novel FADD-like anti-apoptotic molecule that regulates Fas/TNFR1-induced apoptosis (англ.) // J. Biol. Chem. : journal. — 1997. — July (vol. 272, no. 30). — P. 18542—18545. — doi:10.1074/jbc.272.30.18542. — PMID 9228018.
- Micheau O., Thome M., Schneider P., Holler N., Tschopp J., Nicholson D. W., Briand C., Grütter M. G. The long form of FLIP is an activator of caspase-8 at the Fas death-inducing signaling complex (англ.) // J. Biol. Chem. : journal. — 2002. — November (vol. 277, no. 47). — P. 45162—45171. — doi:10.1074/jbc.M206882200. — PMID 12215447.
- Han D. K., Chaudhary P. M., Wright M. E., Friedman C., Trask B. J., Riedel R. T., Baskin D. G., Schwartz S. M., Hood L. MRIT, a novel death-effector domain-containing protein, interacts with caspases and BclXL and initiates cell death (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1997. — October (vol. 94, no. 21). — P. 11333—11338. — doi:10.1073/pnas.94.21.11333. — PMID 9326610.
- Roth W., Stenner-Liewen F., Pawlowski K., Godzik A., Reed J. C. Identification and characterization of DEDD2, a death effector domain-containing protein (англ.) // J. Biol. Chem. : journal. — 2002. — March (vol. 277, no. 9). — P. 7501—7508. — doi:10.1074/jbc.M110749200. — PMID 11741985.
- Srinivasula S. M., Ahmad M., Fernandes-Alnemri T., Litwack G., Alnemri E. S. Molecular ordering of the Fas-apoptotic pathway: the Fas/APO-1 protease Mch5 is a CrmA-inhibitable protease that activates multiple Ced-3/ICE-like cysteine proteases (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1996. — December (vol. 93, no. 25). — P. 14486—14491. — doi:10.1073/pnas.93.25.14486. — PMID 8962078.
- Cowling V., Downward J. Caspase-6 is the direct activator of caspase-8 in the cytochrome c-induced apoptosis pathway: absolute requirement for removal of caspase-6 prodomain (англ.) // Cell Death Differ. : journal. — 2002. — October (vol. 9, no. 10). — P. 1046—1056. — doi:10.1038/sj.cdd.4401065. — PMID 12232792.
- Zhan Y., Hegde R., Srinivasula S. M., Fernandes-Alnemri T., Alnemri E. S. Death effector domain-containing proteins DEDD and FLAME-3 form nuclear complexes with the TFIIIC102 subunit of human transcription factor IIIC (англ.) // Cell Death Differ. : journal. — 2002. — April (vol. 9, no. 4). — P. 439—447. — doi:10.1038/sj.cdd.4401038. — PMID 11965497.
- Alcivar A., Hu S., Tang J., Yang X. DEDD and DEDD2 associate with caspase-8/10 and signal cell death (англ.) // Oncogene : journal. — 2003. — January (vol. 22, no. 2). — P. 291—297. — doi:10.1038/sj.onc.1206099. — PMID 12527898.
- Stegh A. H., Schickling O., Ehret A., Scaffidi C., Peterhänsel C., Hofmann T. G., Grummt I., Krammer P. H., Peter M. E. DEDD, a novel death effector domain-containing protein, targeted to the nucleolus (англ.) // EMBO J. : journal. — 1998. — October (vol. 17, no. 20). — P. 5974—5986. — doi:10.1093/emboj/17.20.5974. — PMID 9774341.
- Oshima S., Turer E. E., Callahan J. A., Chai S., Advincula R., Barrera J., Shifrin N., Lee B., Benedict Yen T. S., Yen B., Woo T., Malynn B. A., Ma A. ABIN-1 is a ubiquitin sensor that restricts cell death and sustains embryonic development (англ.) // Nature : journal. — 2009. — February (vol. 457, no. 7231). — P. 906—909. — doi:10.1038/nature07575. — PMID 19060883.
- Henshall D. C., Araki T., Schindler C. K., Shinoda S., Lan J. Q., Simon R. P. Expression of death-associated protein kinase and recruitment to the tumor necrosis factor signaling pathway following brief seizures (англ.) // J. Neurochem. : journal. — 2003. — September (vol. 86, no. 5). — P. 1260—1270. — doi:10.1046/j.1471-4159.2003.01934.x. — PMID 12911633.
- Boldin M. P., Goncharov T. M., Goltsev Y. V., Wallach D. Involvement of MACH, a novel MORT1/FADD-interacting protease, in Fas/APO-1- and TNF receptor-induced cell death (англ.) // Cell : journal. — Cell Press, 1996. — June (vol. 85, no. 6). — P. 803—815. — doi:10.1016/s0092-8674(00)81265-9. — PMID 8681376.
- Thomas L. R., Stillman D. J., Thorburn A. Regulation of Fas-associated death domain interactions by the death effector domain identified by a modified reverse two-hybrid screen (англ.) // J. Biol. Chem. : journal. — 2002. — September (vol. 277, no. 37). — P. 34343—34348. — doi:10.1074/jbc.M204169200. — PMID 12107169.
- MacFarlane M., Ahmad M., Srinivasula S. M., Fernandes-Alnemri T., Cohen G. M., Alnemri E. S. Identification and molecular cloning of two novel receptors for the cytotoxic ligand TRAIL (англ.) // J. Biol. Chem. : journal. — 1997. — October (vol. 272, no. 41). — P. 25417—25420. — doi:10.1074/jbc.272.41.25417. — PMID 9325248.
- Gervais F. G., Singaraja R., Xanthoudakis S., Gutekunst C. A., Leavitt B. R., Metzler M., Hackam A. S., Tam J., Vaillancourt J. P., Houtzager V., Rasper D. M., Roy S., Hayden M. R., Nicholson D. W. Recruitment and activation of caspase-8 by the Huntingtin-interacting protein Hip-1 and a novel partner Hippi (англ.) // Nat. Cell Biol. : journal. — 2002. — February (vol. 4, no. 2). — P. 95—105. — doi:10.1038/ncb735. — PMID 11788820.
- Koseki T., Inohara N., Chen S., Núñez G. ARC, an inhibitor of apoptosis expressed in skeletal muscle and heart that interacts selectively with caspases (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1998. — April (vol. 95, no. 9). — P. 5156—5160. — doi:10.1073/pnas.95.9.5156. — PMID 9560245.
- Kitsberg D., Formstecher E., Fauquet M., Kubes M., Cordier J., Canton B., Pan G., Rolli M., Glowinski J., Chneiweiss H. Knock-out of the neural death effector domain protein PEA-15 demonstrates that its expression protects astrocytes from TNFalpha-induced apoptosis (англ.) // J. Neurosci. : journal. — 1999. — October (vol. 19, no. 19). — P. 8244—8251. — doi:10.1523/JNEUROSCI.19-19-08244.1999. — PMID 10493725.
- Condorelli G., Vigliotta G., Cafieri A., Trencia A., Andalò P., Oriente F., Miele C., Caruso M., Formisano P., Beguinot F. PED/PEA-15: an anti-apoptotic molecule that regulates FAS/TNFR1-induced apoptosis (англ.) // Oncogene : journal. — 1999. — August (vol. 18, no. 31). — P. 4409—4415. — doi:10.1038/sj.onc.1202831. — PMID 10442631.
- Chaudhary P. M., Eby M. T., Jasmin A., Kumar A., Liu L., Hood L. Activation of the NF-kappaB pathway by caspase 8 and its homologs (англ.) // Oncogene : journal. — 2000. — September (vol. 19, no. 39). — P. 4451—4460. — doi:10.1038/sj.onc.1203812. — PMID 11002417.
- Bertrand M. J., Milutinovic S., Dickson K. M., Ho W. C., Boudreault A., Durkin J., Gillard J. W., Jaquith J. B., Morris S. J., Barker P. A. cIAP1 and cIAP2 facilitate cancer cell survival by functioning as E3 ligases that promote RIP1 ubiquitination (англ.) // Mol. Cell : journal. — 2008. — June (vol. 30, no. 6). — P. 689—700. — doi:10.1016/j.molcel.2008.05.014. — PMID 18570872.
- Leo E., Deveraux Q. L., Buchholtz C., Welsh K., Matsuzawa S., Stennicke H. R., Salvesen G. S., Reed J. C. TRAF1 is a substrate of caspases activated during tumor necrosis factor receptor-alpha-induced apoptosis (англ.) // J. Biol. Chem. : journal. — 2001. — March (vol. 276, no. 11). — P. 8087—8093. — doi:10.1074/jbc.M009450200. — PMID 11098060.