Арсенид алюминия
Арсени́д алюми́ния (AlAs) — бинарное неорганическое химическое соединение алюминия и мышьяка. Применяется для создания оптоэлектронных приборов (светодиодов, полупроводниковых лазеров, фотоприёмников). В гетероструктурах с арсенидом галлия — для изготовления сверхбыстродействующих транзисторов.
| Арсенид алюминия | |
|---|---|
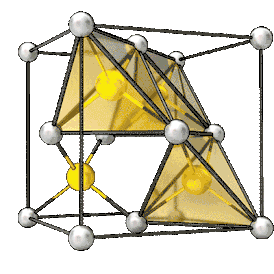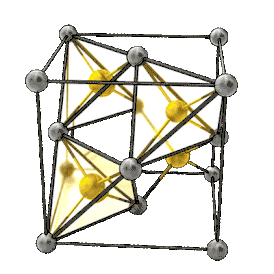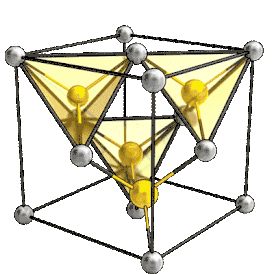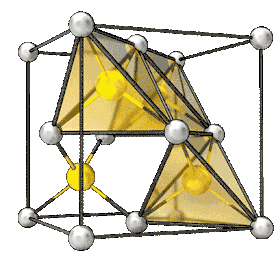 Элементарная ячейка кристаллов типа цинковой обманки Al As | |
| Общие | |
| Систематическое наименование |
арсенид алюминия |
| Хим. формула | AlAs |
| Рац. формула | AlAs |
| Физические свойства | |
| Состояние | твёрдое вещество |
| Молярная масса | 101,903 г/моль |
| Плотность | 3,81 г/см³ |
| Твёрдость | ~5 (по Моосу) |
| Термические свойства | |
| Температура | |
| • плавления | 1740 °C |
| Оптические свойства | |
| Показатель преломления | 3 (ИК) |
| Структура | |
| Координационная геометрия | тетраэдрическая |
| Кристаллическая структура |
кубическая, типа сфалерита, |
| Классификация | |
| Рег. номер CAS | 22831-42-1 |
| PubChem | 89859 |
| Рег. номер EINECS | 245-255-0 |
| SMILES | |
| InChI | |
| ChemSpider | 81112 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Физические свойства
Общие
При нормальных условиях оранжевые кристаллы c кристаллической решеткой типа цинковой обманки (сфалерита), пространственная группа T2d-F-43m, постоянная решетки 0,566 нм.
- Коэффициент линейного термического расширения 5 ppm/К.
- микротвёрдость 5 ГПа.
- Коэффициент объемного сжатия 7,81 дин/см−2.
- Концентрация атомов 4,25*1022 см−3[1].
Полупроводниковые
Непрямозонный полупроводник с шириной запрещённой зоны 2,15 эВ при 300 K. Подвижность электронов ~1200 см2В−1с−1 и их эффективная масса ~ 0,7 me[2].
Химические свойства
При комнатной температуре устойчив в сухом воздухе. Нерастворим в воде, но реагирует с ней (особенно быстро с горячей) или с водяным паром с образованием гидроксида алюминия и арсина. Пыль воспламеняется от контакта с водой.
Бурно реагирует даже со слабыми кислотами с образованием соответствующей соли алюминия и арсина.
Получение
Получают путём длительного нагревания порошков алюминия и мышьяка без доступа воздуха:
- As + Al = AlAs.
Синтез этого соединения, особенно крупных монокристаллов затруднён вследствие очень высокой температуры плавления и агрессивности алюминия при этой температуре. Сообщалось, что некоторым исследователям удалось вырастить монокристаллы AlAs из расплава, наилучшие образцы таких кристаллов с дырочным типом проводимости имели концентрацию носителей ~1019 см−3[3].
Применение
Перспективный полупроводниковый материал для применения в оптоэлектронике, например, для создания полупроводниковых лазеров и др. (см. выше). Недостаток AlAs по сравнению с другими полупроводниовыми материалами типа III-V (GaAs, GaP) — трудность выращивания больших монокристаллов и нестабильность свойств приборов на его основе, обусловленное взаимодействием этого соединения с влагой воздуха.
Постоянные решёток AlAs и GaAs почти равны, что способствует выращиванию малодислокационных монокристаллических плёнок AlAs на GaAs, что позволяет создавать гетеропереходы и сверхрешётки[4] с исключительно высокой подвижностью зарядов, что применяется в СВЧ-приборах, например, в транзисторах с высокой подвижностью электронов[5] и других приборах, использующих эффекты квантовой ямы.
Токсичность, опасность и предосторожности
Весьма ядовит при попадании внутрь, так как при реакции с желудочным соком образуется чрезвычайно ядовитый арсин. Негорюч. Хранить в герметичных сосудах, для избежания взаимодействия с влагой воздуха.
Примечания
- Berger, L. I. Semiconductor Materials (неопр.). — CRC Press, 1996. — С. 125. — ISBN 978-0-8493-8912-2.
- AlxGa1-xAs. Ioffe Database. Sankt-Peterburg: FTI im. A. F. Ioffe, RAN. Архивировано 30 октября 2012 года.
- Willardson, R., and Goering, H. (eds.), Compound Semiconductors, 1, 184 (Reinhold Pub. Corp., New York, 1962).
- Guo, L. Structural, Energetic, and Electronic Properties of Hydrogenated Aluminum Arsenide Clusters. Journal of Nanoparticle Research. Vol. 13 Issue 5 pg. 2029—2039. 2011.
- S. Adachi, GaAs and Related Materials: Bulk Semiconducting and Superlattice Properties. (World Scientific, Singapore, 1994)
