FUT5
Альфа-(1, 3)-фукозилтрансфераза 5 (англ. Alpha-(1,3)-fucosyltransferase 5; КФ 2.4.1.65) — фермент трансфераза, продукт гена человека FUT5[1][2]. Входит в семейство 10 гликозилтрансфераз (фукозилтрансфераз). Участвует в гликозилировании белков.
| FUT5 | ||||||
|---|---|---|---|---|---|---|
| Идентификаторы | ||||||
| Символы | FUT5, FUC-TV, fucosyltransferase 5 | |||||
| Внешние IDs | OMIM: 136835 HomoloGene: 134030 GeneCards: 2527 | |||||
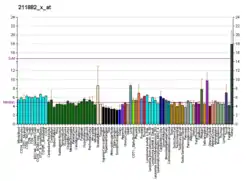
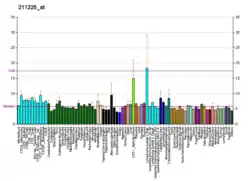
| Профиль экспрессии РНК | ||||||
  | ||||||
| Больше информации | ||||||
| Ортологи | ||||||
| Виды | Человек | Мышь | ||||
| Entrez | ||||||
| Ensembl | ||||||
| UniProt | ||||||
| RefSeq (мРНК) | ||||||
| RefSeq (белок) | ||||||
| Локус (UCSC) | Chr 19: 5.87 – 5.87 Mb | n/a | ||||
| Поиск PubMed | ||||||
| Править (человек) | Править (мышь) | |||||
Функции
Фермент переносит ГДФ-β-L-фукозу на альфа-1,3-гликозидную связь полисахаридной цепи. Участвует в синтезе антигенов VIM-2, Lewis X/SSEA-1 (CD15), сиалил-Lewis X и VIM-2.
Структура и внутриклеточная локализация
FUT5 состоит из 374 аминокислоты, молекулярная масса 43 кДа. Мембранный белок, локализован на мембранах транс-отдела аппарата Гольджи.
Экспрессия
Экспрессирован в печени, толстом кишечнике и яичках. Кроме, этого, более низкий уровень обнаружен в T-лимфоцитах и мозге.
Примечания
- Weston B.W., Nair R.P., Larsen R.D., Lowe J.B. Isolation of a novel human alpha (1,3)fucosyltransferase gene and molecular comparison to the human Lewis blood group alpha (1,3/1,4)fucosyltransferase gene. Syntenic, homologous, nonallelic genes encoding enzymes with distinct acceptor substrate specificities (англ.) // The Journal of Biological Chemistry : journal. — 1992. — February (vol. 267, no. 6). — P. 4152—4160. — PMID 1740457.
- Entrez Gene: FUT5 fucosyltransferase 5 (alpha (1,3) fucosyltransferase).
Литература
- Chiu P.C., Chung M.K., Koistinen R., Koistinen H., Seppala M., Ho P.C., Ng E.H., Lee K.F., Yeung W.S. Glycodelin-A interacts with fucosyltransferase on human sperm plasma membrane to inhibit spermatozoa-zona pellucida binding (англ.) // Journal of Cell Science : journal. — The Company of Biologists, 2007. — January (vol. 120, no. Pt 1). — P. 33—44. — doi:10.1242/jcs.03258. — PMID 17148576.
- Inaba Y., Ohyama C., Kato T., Satoh M., Saito H., Hagisawa S., Takahashi T., Endoh M., Fukuda M.N., Arai Y., Fukuda M. Gene transfer of alpha1,3-fucosyltransferase increases tumor growth of the PC-3 human prostate cancer cell line through enhanced adhesion to prostatic stromal cells (англ.) // International Journal of Cancer : journal. — 2003. — December (vol. 107, no. 6). — P. 949—957. — doi:10.1002/ijc.11513. — PMID 14601054.
- Roos C., Kolmer M., Mattila P., Renkonen R. Composition of Drosophila melanogaster proteome involved in fucosylated glycan metabolism (англ.) // The Journal of Biological Chemistry : journal. — 2002. — February (vol. 277, no. 5). — P. 3168—3175. — doi:10.1074/jbc.M107927200. — PMID 11698403.
- Nishihara S., Iwasaki H., Kaneko M., Tawada A., Ito M., Narimatsu H. Alpha1,3-fucosyltransferase 9 (FUT9; Fuc-TIX) preferentially fucosylates the distal GlcNAc residue of polylactosamine chain while the other four alpha1,3FUT members preferentially fucosylate the inner GlcNAc residue (англ.) // FEBS Letters : journal. — 1999. — December (vol. 462, no. 3). — P. 289—294. — doi:10.1016/S0014-5793(99)01549-5. — PMID 10622713.
- McCurley R.S., Recinos A., Olsen A.S., Gingrich J.C., Szczepaniak D., Cameron H.S., Krauss R., Weston B.W. Physical maps of human alpha (1,3)fucosyltransferase genes FUT3-FUT6 on chromosomes 19p13.3 and 11q21 (англ.) // Genomics : journal. — Academic Press, 1995. — March (vol. 26, no. 1). — P. 142—146. — doi:10.1016/0888-7543(95)80094-3. — PMID 7782074.
- Cameron H.S., Szczepaniak D., Weston B.W. Expression of human chromosome 19p alpha(1,3)-fucosyltransferase genes in normal tissues. Alternative splicing, polyadenylation, and isoforms (англ.) // The Journal of Biological Chemistry : journal. — 1995. — August (vol. 270, no. 34). — P. 20112—20122. — doi:10.1074/jbc.270.34.20112. — PMID 7650030.
- Weston B.W., Smith P.L., Kelly R.J., Lowe J.B. Molecular cloning of a fourth member of a human alpha (1,3)fucosyltransferase gene family. Multiple homologous sequences that determine expression of the Lewis x, sialyl Lewis x, and difucosyl sialyl Lewis x epitopes (англ.) // The Journal of Biological Chemistry : journal. — 1992. — December (vol. 267, no. 34). — P. 24575—24584. — PMID 1339443.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
