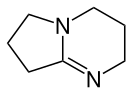
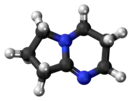
1,5-Диазабицикло(4.3.0)нонен-5
1,5-Диазабицикло[4.3.0]нонен-5 (DBN) — органическое вещество, растворимое амидиновое основание, применяемое в органическом синтезе для проведения различных реакций отщепления, изомеризации, этерификации и конденсации[1].
| 1,5-Диазабицикло[4.3.0]нонен-5[1][2] | |||
|---|---|---|---|
| |||
| Общие | |||
| Сокращения | DBN | ||
| Хим. формула | C7H12N2 | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 124,19 г/моль | ||
| Плотность | 1,005 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • кипения | 95–98 ◦C (7,5 мм рт. ст.) °C | ||
| Оптические свойства | |||
| Показатель преломления | 1,519[3] | ||
| Классификация | |||
| Рег. номер CAS | 3001-72-7 | ||
| PubChem | 24848287 | ||
| Рег. номер EINECS | 221-087-3 | ||
| SMILES | |||
| InChI | |||
| ChemSpider | 68826 | ||
| Безопасность | |||
| Краткие характер. опасности (H) |
H314 |
||
| Меры предостор. (P) |
P260, P280, P303+P361+P353, P304+P340+P310, P305+P351+P338 |
||
| Сигнальное слово | Опасно | ||
| Пиктограммы СГС |
|
||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Строение и физические свойства
Диазабициклононен растворим в воде, этаноле, бензоле, хлористом метилене, хлороформе, тетрагидрофуране и диметилсульфоксиде[1].
Применение
Диазабициклононен является растворимым органическим основанием и в мягких условиях используется для проведения различных органических превращений: отщеплений, изомеризаций, этерификаций и конденсаций. По реакционной способности напоминает 1,8-диазабицикло[5.4.0]ундецен-7 (DBU)[1].
В реакциях отщепления
Диазабициклононен используют в реакциях отщепления галогеноводородов, а также сульфокислот. Обычно применяют кратное количество основания либо его небольшой избыток, тогда как растворителем служат диметилформамид, диметилсульфоксид, бензол, хлористый метилен или хлороформ. Такой подход позволяет создавать как терминальные, так и внутренние двойные связи[1].
Проводилось сравнение диазабициклононена и диазабициклоундецена в реакции отщепления HBr от бромгептанов. Диазабициклононен показал средние результаты, давая гептены с выходом 36–60 %, тогда как диазабициклоундецен показал выходы 78–91 %. Зато диазабициклононен оказался более эффективным для превращения первичных иодалканов в терминальные алкены[1].
В изомеризациях
Диазабициклононен применяют для осуществления эпимеризаций и смещения двойных связей. Типичным примером эпимеризации является превращение 6β-замещённых пенициллинов в соответствующие 6α-изомеры. На примере этого превращения проводилось сравнение различных оснований, и оказалось, что многие альтернативы приводят в образованию побочных продуктов[1].
В конденсациях
Диазабициклононен показал свою действенность в реакциях конденсации с участием соединений, содержащих активные метиленовые фрагменты. Также с помощью диазабициклононена генерируют стабилизированные илиды в реакции Виттига[1].
В этерификациях
В литературе описано несколько примеров использования диазабициклононена в реакциях этерификации, хотя его аналог диазабициклоундецен чаще используется с этой целью. В частности, диазабициклононен использовали на последней стадии полного синтеза антибиотика-макролида пиренофорина[1].
См.также
Примечания
- EROS, 2006.
- 1,5-Diazabicyclo[4.3.0non-5-ene] (англ.). Sigma-Aldrich. Дата обращения: 7 января 2021.
- CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 3—296. — ISBN 978-1-4987-5428-6
Литература
- Savoca A. C., Urgaonkar S. 1,5-Diazabicyclo[4.3.0]non-5-ene (англ.) // Encyclopedia of Reagents for Organic Synthesis. — Wiley, 2006. — doi:10.1002/047084289x.rd010.pub2.
Ссылки
- ЯМР-спектр 1,5-диазабицикло(4.3.0)нонена-5. Sigma-Aldrich. Дата обращения: 29 июля 2019.
- ИК-спектр 1,5-диазабицикло(4.3.0)нонена-5. Sigma-Aldrich. Дата обращения: 29 июля 2019.
- КР-спектр 1,5-диазабицикло(4.3.0)нонена-5. Sigma-Aldrich. Дата обращения: 29 июля 2019.