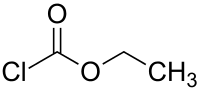
Этилхлорформиат
Этилхлорформиат — органическое вещество, этиловый эфир хлормуравьиной кислоты. В органическом синтезе применяется для этоксикарбонилирования различных нуклеофильных субстратов.
| Этилхлорформиат[1][2] | |
|---|---|
 | |
| Общие | |
| Хим. формула | C3H5ClO2 |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 108,52 г/моль |
| Плотность | 1,135 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | –81 °C |
| • кипения | 95 °C |
| • вспышки | 2 °C |
| Классификация | |
| Рег. номер CAS | 541-41-3 |
| PubChem | 24851187 |
| Рег. номер EINECS | 208-778-5 |
| SMILES | |
| InChI | |
| ChemSpider | 10465 |
| Безопасность | |
| Краткие характер. опасности (H) |
H225, H301, H314, H330, H400 |
| Меры предостор. (P) |
P210, P260, P273, P280, P284, P301+P310 |
| Сигнальное слово | Опасно |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
Очистку этилхлорформиата проводят промыванием водой и последующей перегонкой при атмосферном давлении с использованием дефлегматора и хлоркальциевой трубки. Он медленно разлагается водой[1].
Строение и физические свойства
Этилхлорформиат представляет собой бесцветную жидкость. Он смешивается с бензолом, хлороформом, диэтиловым эфиром, этанолом. Нерастворим в воде. Очень огнеопасен, лакримант, ирритант, токсичен при вдыхании и всасывании через кожу[1].
Химические свойства
Важным свойством этилхлорформиата является его взаимодействие с разнообразными нуклеофилами. Карбоновые кислоты, депротонированные в α-положении двумя эквивалентами диизопропиламида лития, реагируют с этилхлорформиатом, давая моноэфиры малоновых кислот. Формально при этом происходит введение в молекулу этоксикарбонильной группы (этоксикарбонилирование). Этилхлорформиат при этом является более эффективным, чем диэтилкарбонат (хотя обработка подобных дианионов углекислым газом часто даёт ещё более высокий выход малонатов)[1].
Также с хорошим выходом можно этоксикарбонилировать нитрилы, ацетали, 1,3-дитианы. Кетоны необходимо этоксикарбонилировать в виде енаминов[1].
В ряде случаев наблюдается О-этоксикарбонилирование. Так, алифатические спирты, фенолы и циангидрины реагируют с этилхлорформиатом в присутствии третичных аминов, давая карбонаты. У стероидов гидроксильные группы в экваториальном положении ацилируются селективно в присутствии аксиальных гидроксильных групп. При обработке кетонов тетраметилпиперидидом лития образуются литиевые еноляты, которые при обработке этилхлорформиатом дают карбонаты енолов. Енолизацию при этом важно проводить в присутствии ГМФТА, поскольку тогда исключается побочная реакция С-ацилирования. Натриевые и калиевые еноляты продукта ацилирования по атому кислорода не дают[1].
N-Этоксикарбонилирование наблюдается для азотсодержащих нуклеофилов. При этом третичные амины под действием этилхлорформиата могут отщеплять алкильные группы: в частности, существуют примеры N-деметилирования. Фталимид можно этоксикарбонилировать при обработке этилхлорформиатом его калиевой соли[1].
Этилхлорформиат реагирует с карбоновыми кислотами, давая смешанные ангидриды. Исторически эта реакция играла важное значение в синтезе пептидов и белков, однако потом она была заменена более эффективными методами
Примечания
- EROS, 2005.
- Ethyl chloroformate (англ.). Sigma-Aldrich. Дата обращения: 7 января 2020.
Литература
- Payne A. N., Kobayashi Y. Ethyl Chloroformate (англ.) // Encyclopedia of Reagents for Organic Synthesis. — Wiley, 2005. — doi:10.1002/047084289X.re052.pub2.
Ссылки
- ЯМР-спектр этилхлорформиата. Sigma-Aldrich. Дата обращения: 29 июля 2019.
- КР-спектр этилхлорформиата. Sigma-Aldrich. Дата обращения: 29 июля 2019.
