Хромат натрия
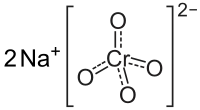
Хромат(VI) натрия — неорганическое соединение, соль металла натрия и хромовой кислоты с формулой Na2CrO4, жёлтые кристаллы, растворимые в воде, образует кристаллогидраты.
| Хромат натрия | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Хромат натрия |
| Традиционные названия | Хромовокислый натрий |
| Хим. формула | Na2CrO4 |
| Физические свойства | |
| Состояние | жёлтые кристаллы |
| Молярная масса | 161,97 г/моль |
| Плотность | 2,723 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 792 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 31,70; 126100 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7775-11-3 |
| PubChem | 24488 |
| Рег. номер EINECS | 231-889-5 |
| SMILES | |
| InChI | |
| RTECS | GB2955000 |
| ChEBI | 78671 |
| Номер ООН | 3288 |
| ChemSpider | 22896 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
- Растворение оксида хрома(VI) в растворе едкого натра:
- Растворения дихромата аммония в гидроксиде натрия:
- (NH4)2Cr2O7 + 4NaOH → 2NH3 + 2Na2CrO4 + 3H2O
- Сплавление оксида хрома(III) с карбонатом или гидроксидом натрия в присутствии окислителей (нитрат натрия, кислород, пероксид натрия, хлорат натрия и др.):
Физические свойства
Хромат натрия(II) образует желтые кристаллы,
Хорошо растворяется в воде и метаноле. Плохо растворим в этаноле.
Образует кристаллогидраты состава Na2CrO4•n H2O, где n = 4, 6 и 10.
Химические свойства
- Кристаллогидраты разлагаются при нагревании:
- В разбавленных кислотах переходит в бихромат натрия:
- В нейтральной и слабощелочной среде способен восстановиться до гидроксида хрома(III):
- В сильнощелочной среде способен восстановиться до гидроксохроматов(III):
Физиологическое действие
Как и все соединения хрома в степени окисления +6, хромат натрия очень ядовит и канцерогенен.
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Неорганическая химия / под ред. Ю.Д. Третьякова. — М.: Академия, 2007. — Т. 3. — 352 с.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.