Хлорид фосфора(III)
Хлори́д фо́сфора(III) (трёххло́ристый фо́сфор, PCl3) — химическое неорганическое соединение фосфора и хлора. Является наиболее важным из трёх известных хлоридов фосфора; ценное химическое сырьё для производства разнообразных фосфорсодержащих органических соединений.
Хлорид фосфора(III) | |
|---|---|
 | |
 | |
Общие | |
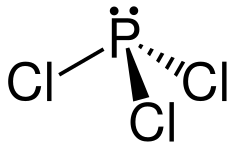
| Хим. формула | Cl₃P |
| Рац. формула | PCl3[1] |
Физические свойства | |
| Молярная масса | 137,33 г/моль |
| Плотность | 1,574 г/см³ |
Термические свойства | |
| Т. плав. | −93,6 ℃ |
| Т. кип. | 76,1 ℃ |
Оптические свойства | |
| Показатель преломления | 1.516 (14 °C) |
Классификация | |
| Номер CAS | 7719-12-2 |
| PubChem | 24387 |
| ChemSpider | 22798 |
| Номер EINECS | 231-749-3 |
| RTECS | TH3675000 |
| ChEBI | 30334 |
| Номер ООН | 1809 |
P(Cl)(Cl)Cl | |
InChI=1S/Cl3P/c1-4(2)3 | |
Безопасность | |
| ПДК | 0,2 мг/м³[2][3] |
| ЛД50 | 15 мг/кг[4] |
| Токсичность | Класс опасности по ГОСТ 12.1.005: 2-й[5] |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Физические свойства
При нормальных условиях трихлорид фосфора — бесцветная, дымящая во влажной среде жидкость с резким неприятным запахом. Обладает слезоточивыми свойствами.
Химические свойства
Фосфор в PCl3 находится в степени окисления +3, а хлор — в степени −1. Многие из свойств соединения обусловлены именно этими обстоятельствами. В присутствии воды — разлагается без дыма.
PCl3 — базовый продукт для других производных фосфора, получаемых из него при окислении до пентахлорида (PCl5), тиофосфорилхлорида (PSCl3) или оксихлорида (POCl3).
Если пропустить электрический разряд через смесь пара PCl3 и газообразного водорода, образуется редкий и сложный хлорид фосфора с формулой P2Cl4.
Известно большое число сходных реакций замещения, в том числе и с органическими веществами — спиртами и фенолами:
Спирты реагируют сходным образом:
Наличие неподелённой электронной пары у атомов фосфора обуславливает способность трёххлористого фосфора проявлять донорные свойства, образуя электронейтральные комплексы, например [Ni(PCl3)4]. По химической природе трихлорид фосфора является хлорангидридом фосфористой кислоты. Гидролиз её приводит к образованию двух кислот, а взаимодействие со щелочами — двух солей:
Особенности обращения, биологическое действие
Трёххлористый фосфор относится к высокоопасным веществам (Класс опасности 2)[7]. При вдыхании вызывает функциональные расстройства центральной нервной системы.
Трёххлористый фосфор принадлежит к группе веществ, обладающих общетоксическим действием[8]. В больших концентрациях трихлорид фосфора раздражает слизистые оболочки глаз и кожи. Может вызывать коррозию металлов.
Рекомендуемая ПДК трёххлористого фосфора в воздухе рабочей зоны составляет 0,2 мг/м³[9][10]; ЛД50 на крысах — 15 мг/кг.
Правовой статус
Является прекурсором — оборот трёххлористого фосфора в Российской Федерации в концентрации свыше 15 % ограничен законодательно[11][12].
Входит список 3 веществ в Конвенции по запрещению химического оружия[13].
Сферы применения
Трихлорид фосфора используется в основном в производстве органических производных фосфора, а также — ядохимикатов и пестицидов[14].
Примечания
- name=https://docs.cntd.ru_Фосфор треххлористый
- name=https://docs.cntd.ru_Phosphorus trichloride
- name=https://docs.cntd.ru_ГОСТ 12.1.005.76. Воздух рабочей зоны. Общие санитарно-гигиенические требования
- name=https://docs.cntd.ru_LD50
- name=https://docs.cntd.ru_ГОСТ 12.1.005.88. ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей зоны
- Clark, Jim (2008). Replacing the OH in alcohols by a halogen. Retrieved October 9 2008.
- name=https://docs.cntd.ru_Меры(недоступная+ссылка) безопасности при обращении с треххлористым фосфором
- name=https://docs.cntd.ru_АХОВ
- name=https://docs.cntd.ru_ПДК
- name=https://docs.cntd.ru_ГОСТ(недоступная+ссылка) 12.1.007.76. ССБТ. Вредные вещества. Классификация и общие требования безопасности
- name=https://docs.cntd.ru_СДЯВ
- name=https://docs.cntd.ru_Precursors
- name=https://docs.cntd.ru_Прекурсоры
- name=https://docs.cntd.ru_Основные сферы применения трихлорида фосфора
Литература
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5 (Три-Ятр). — 783 с. — ISBN 5-85270-310-9.
