Пинаконы
Пинаконы — тетразамещенные этан-1,2-диолы общей формулы R2C(OH)-С(OH)R2, простейший представитель — пинакон (тетраметилэтан-1,2-диол), давший название этому классу виц-диолов[1].
Реакционная способность
Пинаконы — бесцветные кристаллические вещества, хорошо растворимые в этаноле и хлороформе и плохо растворимые в воде. Пинаконы образуют ассоциаты с водой и из водных растворов часто кристаллизуются в виде гидратов, так, пинакон при кристаллизации из горячей воды выпадает в виде гексагидрата (пинаконгидрата).
Реакционная способность сходна с реакционной способностью третичных спиртов — они алкилируются, восстанавливаются йодистоводородной кислотой и т. п.
Специфической особенностью пинаконов являются реакции с перестройкой углеродного скелета.
Так, при нагревании пинаконы способны разлагаться с разрывом центральной связи на кетон и вторичный спирт, в случае бензпинакона (тетрафенилэтан-1,2-диола) такое разложение происходит уже при температуре плавления:
- Ph2C(OH)-С(OH)Ph2 Ph2CO + Ph2CHOH
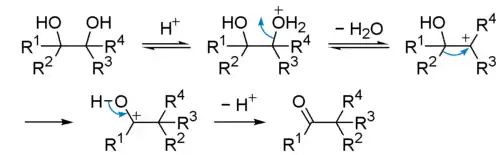
Под действием сильных кислот пинаконы претерпевают перегруппировку типа Вагнера-Меервейна в кетоны (пинаколины) с миграцией одного из заместителей (пинаколиновая перегруппировка):
Синтез
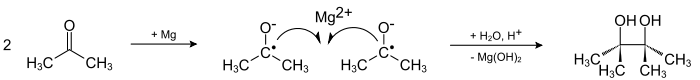
Исторически первым методом синтеза пинаконов является конденсация кетонов при их одноэлектронном восстановлении, идущая через промежуточное образование анион-радикальных интермедиатов — кетилов, эта реакция является классическим методом синтеза пинаконов и в настоящее время:
Восстановление кетонов в пинаконы производят в апротонных неполярных растворителях (бензол, толуол, тетрагидрофуран), используя в качестве восстановителей двухвалентные металлы либо амальгамы магния[2] и алюминия, так как использование двухвалентных металлов повышает выходы пинаконов за счет координации двух кетильных анион-радикалов у катиона металла.
Специфическим методом синтеза ароматических пинаконов является фотохимическое восстановление диарилкетонов изопропанолом под действием ультрафиолетового излучения, в случае бензофенона выходы бензпинакона составляют 93-95 %[3]:
- 2 Ph2CO + (CH3)2CHOH Ph2C(OH)-C(OH)Ph2 + (CH3)2CO
Другой метод синтеза пинаконов — взаимодействие реактивов Гриньяра с α-дикетонами или легкодоступными сложными эфирами щавелевой кислоты. При использовании α-дикетонов образуются пинаконы с различными заместителями у спиртовых атомов углерода:
- RCO-COR + R1MgHal RR1C(OH)-C(OH)RR1 ,
в случае использования алкилоксалатов образуются пинаконы с одинаковыми заместителями у спиртовых атомов углерода:
- ROCO-COOR + R1MgHal R12C(OH)-C(OH)R12
Пинаконы также могут быть синтезированы из тетраалкилэтиленов — как прямым окислением:
- RR1C=CRR1 + [O] + H2O RR1C(OH)-C(OH)RR1 ,
так и галогенированием с последующим гидролизом тетраалкилдигалогенэтанов:
- RR1C=CRR1 + Br2 RR1CBr-CBrRR1
- RR1CBr-CBrRR1 + 2 OH- RR1C(OH)-C(OH)RR1 + 2 Br-
Примечания
- pinacols // IUPAC Gold Book
- Roger Adams and E. W. Adams. Pinacol hydrate. Organic Syntheses, Coll. Vol. 1, p.459 (1941); Vol. 5, p.87 (1925). (недоступная ссылка). Дата обращения: 1 ноября 2011. Архивировано 4 февраля 2012 года.
- W. E. Bachmann. Benzopinacol. Organic Syntheses, Coll. Vol. 2, p.71 (1943); Vol. 14, p.8 (1934). (недоступная ссылка). Дата обращения: 1 ноября 2011. Архивировано 28 июля 2012 года.