Пинаколиновая перегруппировка
Пинакон-пинаколиновая перегруппировка и ретропинаколиновая перегруппировка — общее название реакций взаимных превращений 1,2-диолов и соответствующим им карбонильных соединений, которые сопровождаются 1,2-миграцией заместителей. Пинаколиновая перегруппировка открыта российским химиком Бутлеровым А. М. в 1873 г. В 1907 г. Тиффено М. предложил термин ретропинаколиновая перегруппировка. Обе реакции относятся к реакции перегруппировки Вагнера — Меервейна.

Пинаколиновая перегруппировка
Пинаколиновая перегруппировка — это как правило превращение третичных диолов (пинаконов) в кетоны (пинаколины) действием электрофильных реагентов, в качестве которых выступают кислоты, ангидриды кислот, галогенангидриды кислот, ZnCl2 и др.
Механизм реакции
Пинаколиновая перегруппировка протекает по следующей схеме:
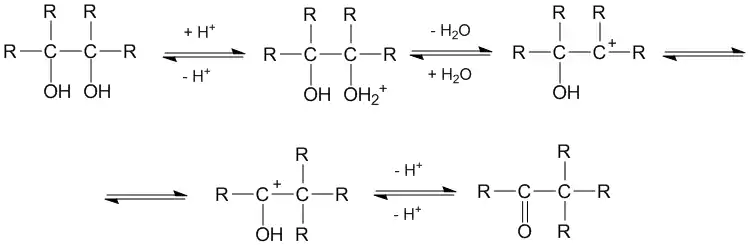
Протонирование одной из спиртовых групп и отщепление молекулы воды вызывает смещение одного из заместителей к возникающему карбениевому центру. При этом образуется более стабильный карбоксониевый катион, который отщепляет протон и превращается в продукт реакции — карбонильное соединение.
В ходе перегруппировки два третичных атома углерода превращаются в один вторичный и один четвертичный.
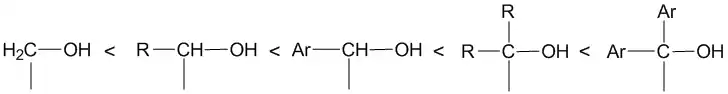
Ввиду того, что преимущественно образуется наиболее стабильный ион карбения, то вероятность отщепления гидроксильной группы возрастает в следующем ряду:
В то же время по склонности к 1,2-перегруппировке реакционноспособность групп увеличивается в ряду:
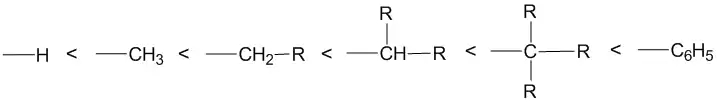
Строение продуктов пинаколиновой перегруппировки определяется также стерическими факторами и условиями среды. Реакция протекает с уменьшением стереоселективности продуктов реакции ввиду возможного вращения по C-C-связи в ходе перегруппировки.
Ретропинаколиновая перегруппировка
Согласно Химической энциклопедии[1], данная реакция заключается в превращениях α-разветвлённых кетонов и альдегидов в соответствующие им 1,2-диолы и их производные. При этом протекает переход одного из α-заместителей к атому углерода карбонильной группы.
Эти реакции возможны в том случае, если термодинамическая стабильность карбоксониевого иона и третичного карбкатиона близки между собой (например, при замене OH-группы на более электроноакцепторную, в частности, на ацилоксигруппу). Такая перегруппировка идёт в результате O-ацилирования кетонов и альдегидов аддуктами ацилхлоридов с кислотами Льюиса в апротонных растворителях, а также при ионизации α-хлоралкилатов.
В то же время согласно другому источнику[2], ретропинаколиновой перегруппировкой является реакция перегруппировки карбкатиона, образовавшегося в результате отщепления OH-группы вторичным спиртом в кислой среде — в случае, если такой карбокатион не содержит α-водородного атома, может отщепиться геминальный протон, а на его место приходит углеводородная группа, прежде находившаяся в α-положении.
Примечания
- Меди — Полимерные // Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1992. — Т. 3. — 639 с.
- Нейланд О. Я. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — с. 294.
Литература
- Меди — Полимерные // Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1992. — Т. 3. — 639 с.
- Нейланд О. Я. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз.
- Гауптман З., Грефе Ю., Ремане Х. Органическая химия. — М.: Химия, 1979. — 832 с.