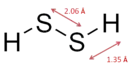Персульфид водорода
Персульфи́д водоро́да (персульфа́н, персероводоро́д, дисероводоро́д) — неорганическое бинарное химическое соединение водорода и серы. Химическая формула
| Персульфид водорода | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
дисульфид диводорода, дисульфид водорода | ||
| Традиционные названия | персульфан, персероводород, дисероводород, двусернистый водород | ||
| Хим. формула | H2S2 | ||
| Физические свойства | |||
| Состояние | жёлтая жидкость | ||
| Молярная масса | 66,14 г/моль | ||
| Плотность | (при 25 °C) 1,3279 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −89,6 °C | ||
| • кипения | (344 K, 159 °F) 70,7 °C | ||
| Классификация | |||
| Рег. номер CAS | 13465-07-1 | ||
| PubChem | 108196 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 33114 | ||
| ChemSpider | 97274 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Физические свойства
Легкокипящая тяжёлая жидкость жёлтого цвета с неприятным запахом. Хорошо растворяет серу, не вступая с ней в реакцию.
Структура
Структура персероводорода аналогична перекиси водорода: два центральных атома серы и два внешних атома водорода. Связь в соединении H—S—S имеет почти стандартный двугранный угол в 90°.
Косой угол в молекуле H2S2 составляет 90,6°, по сравнению с 113,7° у H2O2. Длина связи между двумя атомами O—O, O—H, S—S и S—H равна 1,490, 0,970, 2,055 и 1,352 ангстрем соответственно[1][2].
Синтез и реакции
Персульфид водорода может быть получен путём растворения полисульфидов щелочных или щёлочноземельных металлов в воде. При смешивании с концентрированной соляной кислотой при температуре от −15 °C жёлтое масло, состоящее из смеси полисульфанов (H2Sx, где x > 1) будет оседать ниже водного слоя. Фракционированная конденсация этого масла позволит выделить персульфид водорода отдельно от других полисульфидов (в основном от трисульфида)[3][4].
Персульфид водорода легко разлагается при температуре окружающей среды до сероводорода и серы[4]:
В органической химии персульфид водорода добавляют в алкены, чтобы получить органические дисульфиды и тиолы[5].
Квантовое туннелирование и его подавление в дисульфиде дейтерия
Дейтерированная форма дисульфида водорода DSSD имеет геометрию, подобную своему легководородному аналогу HSSH, но время туннелирования между левой и правой хиральными формами (энантиомерами) у неё больше, что делает дисульфид дейтерия удобным объектом для наблюдения квантового эффекта Зенона (подавления эволюции квантовой системы благодаря частому наблюдению). Трост и Хорнбергер[6] показали, что изолированная молекула D2S2 должна спонтанно осциллировать между двумя хиральными формами с периодом 5,6 миллисекунды (частота 176 Гц), в то время как присутствие небольшого количества инертного гелия стабилизирует эти квантовые состояния, поскольку столкновения атомов гелия с молекулой можно представить как «наблюдение» текущей хиральности молекулы. Эти «наблюдения» подавляют спонтанную эволюцию одного хирального состояния в другое , если повторяются достаточно часто по сравнению с периодом осцилляций (в частности, при температуре 300 К давление гелия должно превышать 1,6×10−8 бар).
Влияние на здоровье
Персульфид водорода был описан как «имеющий раздражающий запах», который похож на камфору или хлориды серы (S2Cl2), вызывает «слезоточивость и жгучее ощущение в носу»[4]. Если он присутствует в высокой концентрации, то может вызваться головокружение, дезориентация и в конечном счёте беспамятство[7].
Примечания
- Davies, D. W. Photoelectron spectra of hydrogen peroxide and hydrogen disulfide: ab initio calculations. — Chemical Physics Letters, 1974. — С. 520—522. — doi:10.1016/0009-2614(74)80093-X.
- P. Lazzeretti и R. Zanasi. On the calculation of parity-violating energies in hydrogen peroxide and hydrogen disulfide molecules within the random-phase approximation. — Chemical Physics Letters, 1997. — Вып. 279. — С. 349—354. — doi:10.1016/S0009-2614(97)01060-9.
- De, A. K. A Text Book of Inorganic Chemistry (неопр.). — ISBN 9788122413847.
- Walton и Parson. Preparation and Properties of the Persulfides of Hydrogen. — J. Amer. Chem. Soc., 1921. — Вып. 43. — С. 2539—2548. — doi:10.1021/ja01445a008.
- Hazardous Reagents, Robinson Brothers
- J. Trost and K. Hornberger. Hund’s Paradox and the Collisional Stabilization of Chiral Molecules // Phys. Rev. Lett.. — 2009. — Vol. 103. — P. 023202. — doi:10.1103/PhysRevLett.103.023202. — arXiv:0811.2140.
- Stein, Wilkinson, G. Seminars in general adult psychiatry. — Royal College of Psychiatrists, 2007. — ISBN 9781904671442.