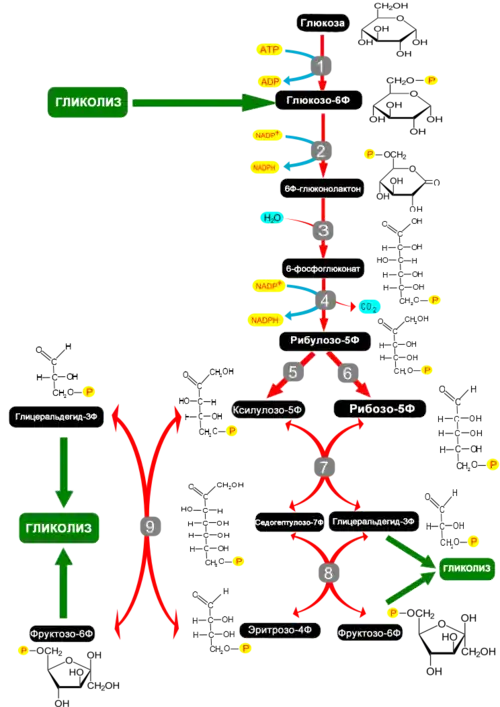
Пентозофосфатный путь
Пентозофосфа́тный путь (пентозный путь, гексозомонофосфатный шунт[1], путь Варбурга — Диккенса — Хорекера[2]) — альтернативный путь окисления глюкозы (наряду с гликолизом и путём Энтнера — Дудорова), включает в себя окислительный и неокислительный этапы.
Суммарное уравнение пентозофосфатного пути:
- 3 глюкозо-6-фосфат + 6 НАДФ+ → 3СО2 + 6 (НАДФH + Н+) + 2 фруктозо-6-фосфат + глицеральдегид-3-фосфат[3].
В дальнейшем глицеральдегид-3-фосфат превращается в пируват с образованием двух молекул АТФ[2].
Пентозофосфатный путь распространён у растений и животных, а у большинства микроорганизмов имеет только вспомогательное значение[2]. Ферменты пентозофосфатного пути располагаются в цитозоле и животных, и растительных клеток; кроме того, в клетках млекопитающих они располагаются также в эндоплазматическом ретикулуме, а у растений — в хлоропластах[4].
Подобно гликолизу, пентозофосфатный путь, по-видимому, имеет очень древнюю эволюционную историю. Возможно, в древних водах архея ещё до возникновения жизни происходили реакции пентозофосфатного цикла, катализируемые не ферментами, как в живых клетках, а ионами металлов, в частности, Fe2+[5].
Реакции
Как отмечалось выше, пентозофосфатный путь подразделяется на окислительный и неокислительный этапы. В ходе окислительного этапа глюкоза, фосфорилируемая до глюкозо-6-фосфата, окисляется до рибулозо-5-фосфата, и при этом образуется два[6] восстановленных NADPH. В ходе неокислительного этапа восстановительные эквиваленты не образуются, он служит для синтеза пентоз и включает в себя обратимые реакции переноса двух или трёх углеродных фрагментов; в дальнейшем пентозы вновь могут быть переведены в гексозы при избытке пентоз в клетке за счёт обратимости неокислительных реакций пентозофосфатного пути[7]. Все ферменты, задействованные в пентозофосфатном пути, можно подразделить на три системы ферментов:
- система дегидрирования — декарбоксилирования;
- изомеризующая система;
- система, осуществляющая перестройки сахаров[8].
Окислительный этап
Последовательность реакций окислительного этапа пентозофосфатного пути представлена в таблице[8][3]:
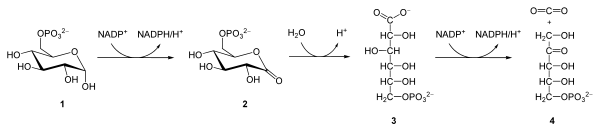
| Субстраты | Продукты | Фермент | Описание |
| Глюкозо-6-фосфат + NADP+ | → 6-фосфоглюконо-δ-лактон + NADPH+H+ | Глюкозо-6-фосфатдегидрогеназа | Дегидрирование. Гидроксильная группа при первом атоме углерода глюкозо-6-фосфата превращается в карбонильную, образуя лактон, при этом также происходит восстановление NADPH. |
| 6-Фосфоглюконо-δ-лактон + H2O | → 6-фосфоглюконат + H+ | 6-Фосфоглюконолактоназа | Гидролиз |
| 6-Фосфоглюконат + NADP+ | → Рибулозо-5-фосфат + NADPH + CO2 | 6-Фосфоглюконатдегидрогеназа | 6-Фосфоглюконатдегидрогеназа катализирует и дегидрирование, сопровождающееся восстановлением NADP, и декарбоксилирование. |
Суммарное уравнение окислительного этапа:
- Глюкозо-6-фосфат + 2 NADP+ + H2O → рибулозо-5-фосфат + 2 (NADPH + H+) + CO2.
Неокислительный этап
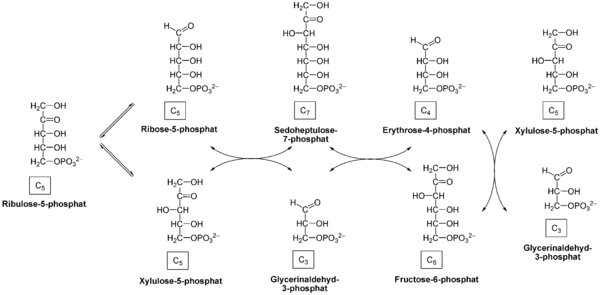
Общая последовательность реакций неокислительного пути такова[3][9]:
| Субстраты | Продукты | Фермент |
| Рибулозо-5-фосфат | ⇌ Рибозо-5-фосфат | Рибулозо-5-фосфатизомераза |
| Рибулозо-5-фосфат | ⇌ Ксилулозо-5-фосфат | Рибулозо-5-фосфат-3-эпимераза |
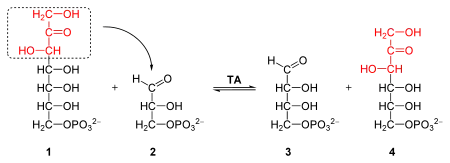
| Ксилулозо-5-фосфат + рибозо-5-фосфат | ⇌ Глицеральдегид-3-фосфат + седогептулозо-7-фосфат | Транскетолаза |
| Седогептулозо-7-фосфат + глицеральдегид-3-фосфат | ⇌ Эритрозо-4-фосфат + фруктозо-6-фосфат | Трансальдолаза |
| Ксилулозо-5-фосфат + эритрозо-4-фосфат | ⇌ Глицеральдегид-3-фосфат + фруктозо-6-фосфат | Транскетолаза |
Трансальдолаза и транскетолаза катализируют разрыв связи С—С и перенос фрагментов углеродной цепи, получающихся при этом разрыве[4]. Транскетолаза в качестве кофермента использует тиаминпирофосфат (ТРР), представляющий собой дифосфорный эфир витамина В1[10]. Ниже представлены схемы трансальдолазной и транскетолазной реакций.

Суммарное уравнение неокислительного этапа:
- 3 рибулозо-5-фосфат → 1 рибозо-5-фосфат + 2 ксилулозо-5-фосфат → 2 фруктозо-6-фосфат + глицеральдегид-3-фосфат.
Реакции окислительного пути протекают только в том случае, если восстановленный NADPH расходуется клеткой, то есть переходит в исходное невосстановленное состояние (NADP+). Если же потребность в NADPH у клетки незначительна, то рибозо-5-фосфат образуется в результате обратимых реакций неокислительного этапа пентозофосфатного пути, где исходными реагентами служат метаболиты гликолиза — глицеральдегид-3-фосфат и фруктозо-6-фосфат[3].
Выбор гликолиза или пентозофосфатного пути клеткой в данный момент определяется её нуждами в этот момент и концентрацией NADP+ в цитозоле. В отсутствие этого акцептора электронов первая реакция пентозофосфатного пути не может произойти. Если же клетка активно расходует NADPH, то концентрация NADP+ растёт, из-за чего активируется глюкозо-6-фосфатдегидрогеназа и пентозофосфатный путь, чтобы восстанавливать окисленный NADPH. Когда потребление NADPH снижается, концентрация NADP+ падает, пентозофосфатный путь приостанавливается и глюкозо-6-фосфат вовлекается в гликолиз[11].
Пентозофосфатный цикл
Из суммарного уравнения неокислительного этапа видно, что из пентоз, образовавшихся при декарбоксилировании гексозы — глюкозы, при помощи пентозофосфатного пути можно вновь вернуться к гексозам. В связи с этим окислительный этап пентозофосфатного пути и дальнейшее превращение пентоз в гексозы составляют циклический процесс — пентозофосфатный цикл. Пентозофосфатный цикл функционирует главным образом лишь в жировой ткани и печени. Его суммарное уравнение выглядит следующим образом:
- 6 глюкозо-6-фосфат + 12NADP + 2H2O → 12(NADPH + H+) + 5 глюкозо-6-фосфат + 6 СО2[10].
Неокислительный пентозофосфатный путь
Перестройка глюкозы в пентозы может осуществляться и без отщепления углекислого газа при помощи системы ферментов перестройки сахаров и гликолитических ферментов, переводящих глюкозо-6-фосфат в глицеральдегид-3-фосфат. При этом происходят перестройки следующего вида[12]:
- 2½ С6 → 3 С5.
При изучении метаболизма красных липидообразующих дрожжей Rhodotorula gracilis (у этих дрожжей отсутствует фосфофруктокиназа, и они неспособны к окислению сахаров путём гликолиза) выяснилось, что у них 20 % глюкозы окисляется по пентозофосфатному пути, а 80 % перестраивается по неокислительному пентозофосфатному пути. Однако к настоящему моменту неизвестно, как именно в этом случае образуются трёхуглеродные соединения, если гликолиз невозможен[12].
Модификации
Несколько исследований, проведённых с меченной радиоактивными изотопами глюкозой, подтвердили описанный выше химизм пентозофосфатного пути. Тем не менее, было высказано предположение, что в печени происходят некоторые отклонения от перестройки сахаров в пентозофосфатном пути, в частности, образование из рибозо-5-фосфата арабинозо-5-фосфата, октулозобифосфата и октулозо-8-фосфата, однако многие исследователи предполагают, что важность этих дополнительных реакций незначительна[12].
Распространение и биологическое значение
Как отмечалось выше, пентозофосфатный путь имеется у животных, растений и микроорганизмов. У всех клеток этот путь служит для образования восстановленного NADPH, который используется как донор водорода в реакциях восстановления и гидроксилирования, а также обеспечивает клетки рибозо-5-фосфатом[13]. Хотя NADPH образуется также при окислении малата до пирувата и углекислого газа, а также при дегидрировании изоцитрата, в большинстве случаев потребности клеток в восстановительных эквивалентах удовлетворяются именно за счёт пентозофосфатного пути[3]. Впрочем, в некоторых случаях образование рибозо-5-фосфата является единственным назначением пентозофосфатного пути[4]. Рибозо-5-фосфат служит предшественником 5-фосфорибозил-1-пирофосфата (PRPP), который участвует в биосинтезе нуклеотидов и нуклеиновых кислот, аминокислот гистидина и триптофана. Другой интермедиат пентозофосфатного пути, эритрозо-4-фосфат, конденсируясь с фосфоенолпируватом, даёт начало общей части пути биосинтеза триптофана, фенилаланина и тирозина[14].
Пентозофосфатный путь может функционировать в печени, жировой ткани, молочной железе при лактации, семенниках[3], коре надпочечников, эритроцитах. В этих тканях и органах активно протекают реакции гидроксилирования и восстановления, например, при синтезе жирных кислот, холестерола, обезвреживания ксенобиотиков в печени и активных форм кислорода в эритроцитах и других тканях, поэтому у них велика потребность в восстановительных эквивалентах, в том числе, NADPH. В частности, в эритроцитах обезвреживание активных форм кислорода выполняет антиоксидант глутатион — серосодержащий трипептид. Глутатион, окисляясь, переводит активные формы кислорода в инактивные, однако для перевода глутатиона обратно в восстановленную форму необходим NADPH + H+. При дефекте глюкозо-6-фосфатдегидрогеназы в эритроцитах происходит агрегация протомеров гемоглобина, из-за чего эритроциты теряют пластичность, для их функционирования необходима нормальная работа пентозофосфатного пути[15]. Интересно, что некоторые нарушения активности (но не функций) глюкозо-6-фосфатдегидрогеназы связаны с устойчивостью к малярийному плазмодию Plasmodium falciparum среди выходцев из Африки и Средиземноморья, поскольку из-за более слабой мембраны эритроциты, в которых часть своего жизненного цикла проводит плазмодий, не могут обеспечить его эффективного размножения[16]. Кроме эритроцитов, высокая активность глюкозо-6-фосфатдегидрогеназы выявлена в фагоцитирующих лейкоцитах, где фермент NADPH-оксидаза использует восстановленный NADPH для образования супероксидного иона из молекулярной формы кислорода[3].
Как было отмечено выше, для функционирования транскетолазы необходим тиаминпирофосфат (ТРР), который образуется из тиамина (витамина В1). Мутации в гене транскетолазы, приводящие к образованию фермента со сниженным сродством ТРР (одна десятая от нормальной активности), делают организм человека более чувствительным к нехватке тиамина в пище. Даже при умеренном недостатке ТРР у этих индивидуумов значительно замедляется пентозофосфатный путь. Подобные мутации усугубляют симптомы синдрома Вернике — Корсакова — заболевания, обусловленного серьёзной тиаминовой недостаточностью[11].
У растений реакции пентозофосфатного пути в обратном направлении составляют восстановительный пентозофосфатный путь — основу темновых (то есть сахарообразующих) реакций фотосинтеза[8]. Пентозофосфатный путь может иметь особое значение для некоторых экологических групп растений. Так, в отличие от животных, цветковое растение Craterostigma plantagineum накапливает большие количества 2-оксо-октулозы. Это растение способно противостоять сильной дегидратации и быстро восстанавливать водные запасы, возвращаясь к нормальному метаболизму за несколько часов. При обезвоживании большая часть октулозы переводится в сахарозу. Оказалось, что у этого растения имеется большое количество генов, кодирующих транскетолазу, которые, возможно, играют ключевую роль во взаимопревращениях сахаров[12].
У многих бактерий отсутствует циклический вариант пентозофосфатного пути, и пентозофосфатный путь используется для образования пентоз и NADPH, как и у эукариот. Неокислительные реакции пентозофосфатного пути могут также использоваться в метаболизме глюконата. Пентозофосфатный цикл функционирует у многих цианобактерий, поскольку у них отсутствует полный цикл Кребса (они неспособны окислять ацетил-СоА) и пути биосинтеза начинаются с превращений триозофосфатов. По той же причине некоторые уксуснокислые бактерии (Gluconobacter spp.) осуществляют пентозофосфатный цикл, и синтезированные в ходе него триозофосфаты окисляются только до ацетата, выделяемого во внешнюю среду. Наконец, некоторые бактерии (Thiobacillus novellus и Brucella abortus) используют пентозофосфатный путь как основной способ окисления сахаров, заменяя им гликолиз и путь Энтнера — Дудорова[17].

Регуляция
Судьба глюкозо-6-фосфата — вступит ли он в гликолиз или пентозофосфатный путь — определяется потребностями клетки в данный момент, а также концентрацией NADP+ в цитозоле. Без наличия акцептора электронов первая реакция пентозофосфатного пути (катализируемая глюкозо-6-фосфатдегидрогеназой) не будет идти. Когда клетка быстро переводит NADPH в NADP+ в биосинтетических восстановительных реакциях, уровень NADP+ поднимается, аллостерически стимулируя глюкозо-6-фосфатдегидрогензазу и тем самым увеличивая ток глюкозо-6-фосфата через пентозофосфатный путь. Когда потребление NADPH замедляется, уровень NADP+ снижается, и глюкозо-6-фосфат утилизируется гликолитически[11].
История изучения
История открытия пентозофосфатного пути началась тогда, когда было замечено, что некоторые общие ингибиторы гликолиза (например, иодоацетат, флюорид) не изменяют потребление глюкозы. Вместе с этим Отто Варбург открыл NADPH и описал окисление глюкозо-6-фосфата до 6-фосфоглюконовой кислоты. Кроме того, было показано, что глюкоза, меченная изотопом 14C по С-1, превращалась в 14СО2 быстрее, чем меченная по С-6. Если бы превращения глюкозы происходили только в ходе гликолиза, то 14СО2 в равной мере образовывался из глюкозы, меченной и по С-1, и по С-6. Таким образом, была доказана возможность утилизации глюкозы по альтернативному пути, отличному от гликолиза[18]. Полная последовательность реакций пентозофосфатного пути, в том числе транскетолазных и трансальдолазных реакций, была опубликована в 1955 году И. К. Гансалусом (англ. I. C. Gunsalus) и У. А. Вудом (англ. W. A. Wood)[19].
Примечания
- Пентозофосфатный путь — статья из Биологического энциклопедического словаря
- Нетрусов, Котова, 2012, с. 123.
- Биохимия: Пентозофосфатный путь превращения глюкозы (недоступная ссылка). Дата обращения: 14 июля 2014. Архивировано 30 июля 2013 года.
- Metzler, 2003, p. 964.
- Keller M. A., Turchyn A. V., Ralser M. Non-enzymatic glycolysis and pentose phosphate pathway-like reactions in a plausible Archean ocean. (англ.) // Molecular systems biology. — 2014. — Vol. 10. — P. 725. — PMID 24771084.
- Nelson, Cox, 2008, p. 560.
- Северин, 2011, с. 271—272.
- Metzler, 2003, p. 963.
- Metzler, 2003, p. 964—965.
- Северин, 2011, с. 272.
- Nelson, Cox, 2008, p. 563.
- Metzler, 2003, p. 965.
- Северин, 2011, с. 271.
- Nelson, Cox, 2008, p. 861.
- Северин, 2011, с. 272, 274.
- Cappadoro M., Giribaldi G., O'Brien E., Turrini F., Mannu F., Ulliers D., Simula G., Luzzatto L., Arese P. Early phagocytosis of glucose-6-phosphate dehydrogenase (G6PD)-deficient erythrocytes parasitized by Plasmodium falciparum may explain malaria protection in G6PD deficiency. (англ.) // Blood. — 1998. — Vol. 92, no. 7. — P. 2527—2534. — PMID 9746794.
- Современная микробиология / Под ред. Й. Ленгелера, Г. Древса, Г. Шлегеля. — М.: Мир, 2005. — Т. 1. — С. 266—267. — 654 с.
- Keshav Trehan. Biochemistry. — New Delphi: New Age International, 1990. — С. 301. — 580 с. — ISBN 81-224-0248-8.
- Bernard L. Horecker. The Pentose Phosphate Pathway // The Journal of Biological Chemistry. — 2002. — Т. 277. — С. 47965—47971. — doi:10.1074/jbc.X200007200.
Литература
- David E. Metzler. Biochemistry: The Chemical Reactions of Living Cells. — 2nd edition. — Academic Press, 2003. — Т. 2. — 1973 с. — ISBN 978-0-1249-2541-0.
- David L. Nelson, Michael M. Cox. Lehninger Principles of biochemistry. — Fifth edition. — New York: W. H. Freeman and company, 2008. — 1158 p. — ISBN 978-0-7167-7108-1.
- Биологическая химия с упражнениями и задачами / Под ред. С. Е. Северина. — М.: Издательская группа «ГЭОТАР-Медиа», 2011. — 624 с.
- Нетрусов А. И., Котова И. Б. Микробиология. — 4-е изд., перераб. и доп.. — М.: Издательский центр «Академия», 2012. — 384 с. — ISBN 978-5-7695-7979-0.