Нуклеозидные амидофосфиты
Нуклеозидные амидофосфиты — это производные природных или синтетических нуклеозидов, которые используются для синтеза олигонуклеотидов, относительно коротких фрагментов ДНК, и их аналогов. Нуклеозидные амидофосфиты были впервые предложены Бокажем (Beaucage) и Карузерсом (Caruthers) в 1981 году[1]. Они представляют собой мономерные строительные блоки, последовательная конденсация которых друг к другу позволяет получить олигонуклеотидную цепь необходимой длины и последовательности, при этом в структуре амидофосфитного реагента остаток сахара и азотистое основание присутствуют в явном виде, а место фосфатного остатка занимает реакционноспособная амидофосфитная группа, которую в процессе синтеза превращают в фосфодиэфирную связь.

Кроме классических 2-дезоксирибонуклеозидных амидофосфитов существуют аналогичные реагенты на основе рибонуклеозидов, LNA, морфолино, 2'-модифицированных нуклеозидов, нуклеозидов с неканоническими основаниями или нуклеозидов, модифицированных флуоресцентным красителем или линкерной группой.
Синтез
Наиболее широко применяются два метода синтеза нуклеозидных амидофосфитов. Нуклеозидный амидофосфит можно получить путём введения в реакцию защищённого нуклеозида, содержащего лишь одну свободную гидроксильную группу, обычно, в 3'-положении, с бис(N,N-диизопропиламино)-2-цианэтоксифосфином[2] в присутствии слабой кислоты в качестве катализатора. При этом происходит замещение одной диизопропиламинной группы с образованием новой связи P—O[3]. Фосфитилирующий реагент является достаточно устойчивым и может быть синтезирован в две стадии с последующей очисткой вакуумной перегонкой[2].
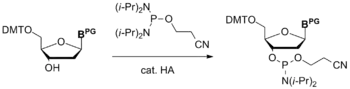
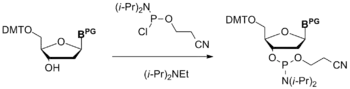
В другом методе синтеза в качестве фосфитилирующего реагента используется N,N-диизопропиламино-2-цианэтоксихлорфосфин. Реакция между защищённым нуклеозидом и данным реагентом проводится в присутствии основания, обычно, диизопропилэтиламина[4].
Синтезированные нуклеозидные амидофосфиты очищают путём колоночной хроматографии на силикагеле. Чистота получаемого продукта может быть определена по 31P ЯМР-спектрам. Хиральный атом P(III) даёт два сигнала, соответствующие двум диастереомерам, в области около 149 м. д. Примесный фосфитный триэфир может давать сигналы при 138—140 м. д., а H-фосфонат — при 8 и 10 м. д.
Устойчивость
Нуклеозидные амидофосфиты являются относительно устойчивыми соединениями, имеющими длительное время жизни при хранении в твёрдом виде в безводных условиях и в отсутствие воздуха при температуре ниже 4°C. Амидофосфиты хорошо выдерживают слабощелочные условия. Напротив, в присутствии следов кислот они разлагаются очень быстро. Амидофосфиты относительно устойчивы к гидролизу в нейтральной среде. Так, время полураспада амидофосфитного производного тимидина в 95%-ом водном ацетонитриле при 25°C составляет 200 ч.[5]
Химические свойства
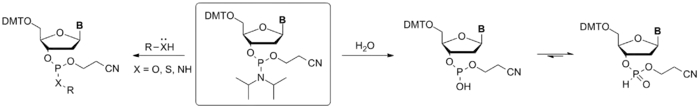
Основным свойством нуклеозидных амидофосфитов является их способность реагировать с нуклеофильными соединениями в присутствии катализатора, например, 1H-тетразола, 2-этилтиотетразола[6], 2-бензилтиотетразола[7], 4,5-дицианимидазола[8] и др. Данная реакция протекает весьма быстро и с высоким выходом, что позволяет применять нуклеозидные амидофосфиты синтезе олигонуклеотидов, где нуклеофилом служит 5'-гидроксильная группа растущей цепи. Стереохимическим результатом реакции является эпимеризация (образование двух диастереомеров) при хиральном атоме P(III).
Если нуклеофилом выступает вода, то амидофосфит превращается в H-фосфонат, что является распространённой проблемой при использовании неабсолютных растворителей в синтезе нуклеозидных амидофосфитов.
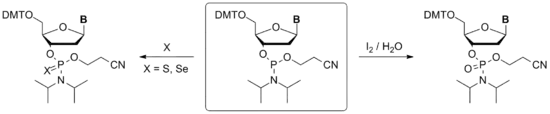
Амидофосфиты легко окисляются слабыми окислителями, например, йодом в присутствии слабого основания или пероксидом водорода с образованием соответствующих амидофосфатов[9]. Подобным образом амидофосфиты реагируют и с другими халькогенами. При введении во взаимодействие с серой[9] либо сульфурирующими реагентами[10] амидофосфит количественно превращается в амидотиофосфат. Реакция с селеном[9] или производными селена[11] даёт амидоселенофосфаты. Конфигурация атома фосфора в реакциях подобного типа сохраняется.
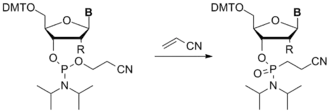
Амидофосфиты также могут вступать в реакцию Арбузова с образованием соответствующих амидофосфонатов. В частности, описан синтез амидофосфонатов с участием акрилонитрила[12]. При комнатной температуре реакция протекает стереоселективно с сохранением конфигурации при хиральном атоме Р. Если реакцию проводить при нагревании, образуется рацемический продукт.
См. также
Примечания
- Beaucage S. L., Caruthers M. H. Deoxynucleoside phosphoramidites — A new class of key intermediates for deoxypolynucleotide synthesis (англ.) // Tetrahedron Lett. — 1981. — Vol. 22, no. 20. — P. 1859–1862. — doi:10.1016/S0040-4039(01)90461-7.
- Nielsen J., Dahl O. Improved synthesis of (Pri2N)2POCH2CH2CN (англ.) // Nucl. Acids Res. — 1987. — Vol. 15, no. 8. — P. 3626. — doi:10.1093/nar/15.8.3626.
- Nielsen J., Taagaard M., Marugg J. E., van Boom J. H., Dahl O. Application of 2-cyanoethyl N,N,N′,N′-tetraisopropylphosphorodiamidite for in situ preparation of deoxyribonucleoside phosphoramidites and their use in polymer-supported synthesis of oligodeoxyribonucleotides (англ.) // Nucl. Acids Res. — 1986. — Vol. 14, iss. 18. — P. 7391-7403. — doi:10.1093/nar/14.18.7391.
- Sinha N. D., Biernat J., Köster H. β-Cyanoethyl N,N-dialkylamino/N-morpholinomonochloro phosphoamidites, new phosphitylating agents facilitating ease of deprotection and work-up of synthesized oligonucleotides (англ.) // Tetrahedron Lett. — 1983. — Vol. 24, iss. 52. — P. 5843–5846. — doi:10.1016/S0040-4039(00)94216-3.
- Guzaev A. P., Manoharan M. 2-Benzamidoethyl Group − A Novel Type of Phosphate Protecting Group for Oligonucleotide Synthesis (англ.) // J. Am. Chem. Soc. — 2001. — Vol. 123, iss. 5. — P. 783–793. — doi:10.1021/ja0016396.
- Sproat B., Colonna F., Mullah B., Tsou D., Andrus A., Hampel A., Vinayak R. An Efficient Method for the Isolation and Purification of Oligoribonucleotides (англ.) // Nucleosides and Nucleotides. — 1995. — Vol. 14, no. 1-2. — P. 255-273. — doi:10.1080/15257779508014668.
- Welz R., Müller S. 5-(Benzylmercapto)-1H-tetrazole as activator for 2′-O-TBDMS phosphoramidite building blocks in RNA synthesis (англ.) // Tetrahedron Lett. — 2002. — Vol. 43, no. 5. — P. 795–797. — doi:10.1016/S0040-4039(01)02274-2.
- Vargeese C., Carter J., Yegge J., Krivjansky S., Settle A., Kropp E., Peterson K., Pieken W. Efficient activation of nucleoside phosphoramidites with 4,5-dicyanoimidazole during oligonucleotide synthesis (англ.) // Nucl. Acids Res. — 1998. — Vol. 26, no. 4. — P. 1046-1050. — doi:10.1093/nar/26.4.1046.
- Gács-Baitz E., Sipos F., Egyed O., Sági G. Synthesis and structural study of variously oxidized diastereomeric 5′-dimethoxytrityl-thymidine-3′-O-[O-(2-cyanoethyl)-N,N-diisopropyl]-phosphoramidite derivatives. Comparison of the effects of the PO, PS, and PSe functions on the NMR spectral and chromatographic properties (англ.) // Chirality. — 2009. — Vol. 21, no. 7. — P. 663–673. — doi:10.1002/chir.20653.
- Guzaev A. P. Reactivity of 3H-1,2,4-dithiazole-3-thiones and 3H-1,2-dithiole-3-thiones as sulfurizing agents for oligonucleotide synthesis (англ.) // Tetrahedron Lett. — 2011. — Vol. 52, no. 3. — P. 434–437. — doi:10.1016/j.tetlet.2010.11.086.
- Holloway G. A., Pavot C., Scaringe S. A., Lu Y., Rauchfuss T. B. An Organometallic Route to Oligonucleotides Containing Phosphoroselenoate (англ.) // ChemBioChem. — 2002. — Vol. 3, no. 11. — P. 1061–1065. — doi:10.1002/1439-7633(20021104)3:11<1061::AID-CBIC1061>3.0.CO;2-9.
- Ravikumar V. T., Kumar R. K. Stereoselective Synthesis of Alkylphosphonates: A Facile Rearrangement of Cyanoethyl-Protected Nucleoside Phosphoramidites (англ.) // Org. Proc. Res. Dev. — 2004. — Vol. 8, no. 4. — P. 603–608. — doi:10.1021/op030035u.