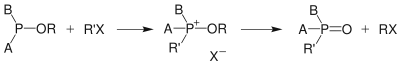Реакция Арбузова
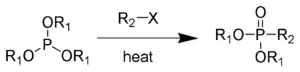
Реакция Арбузова (реакция Михаэлиса — Арбузова, перегруппировка Арбузова) — в классическом варианте — алкилирование триалкилфосфитов алкилгалогенидами с образованием диалкилфосфонатов:
В случае, если алкильные заместители триалкилфосфита и алкилгалогенида R1 и R2 одинаковы, то говорят о перегруппировке Арбузова. Реакция открыта в 1898 году Августом Михаэлисом[1] и детально исследована Александром Арбузовым[2][3].
В настоящее время реакция Арбузова используется не только для синтеза фосфонатов из фосфитов, но и для получения фосфорильных соединений со связью C-P алкилированием или арилированием полных эфиров кислот трехвалентного фосфора:
Механизм реакции
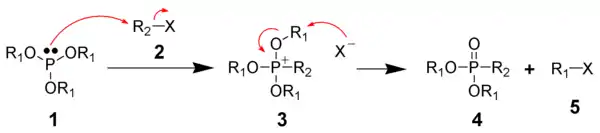
Реакция Арбузова идет через промежуточное образование фосфониевых солей с их дальнейшей перегруппировкой. На первой стадии происходит алкилирование по механизму SN2 алкилгалогенидом 2 триалкилфосфита 1 с образованием триалкоксифосфониевой соли 3.
На следующей стадии происходит нуклеофильная атака галогенид-иона на электрофильный атом углерода алкоксигруппы с отщеплением алкилгалогенида 5 и образованием диалкилфосфоната 4, эта стадия получила название перегруппировки Арбузова.
По аналогичному механизму протекает и алкилирование фосфинитов (A, B = R) и фосфонитов (A = R, B = OR):
В реакцию Арбузова вступают и тиоаналоги эфиров кислот трехвалентного фосфора:
однако в этом случае реакция осложняется конкурирующим алкилированием серы с дальнейшим отщеплением сульфида:
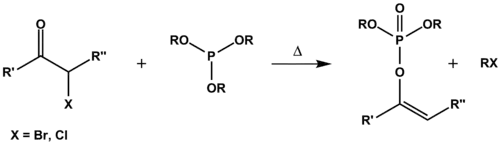
В случае алкилирования фосфитов α-галогенальдегидами и α-галогенкетонами параллельно с реакцией Арбузова, ведущей к фосфонатам, может протекать образование винилфосфатов (реакция Перкова):
Применимость и модификации
В классическом синтезе триалкилфосфонатов из триалкилфосфитов используемый в реакции алкилгалогенид идентичен образующемуся, поэтому его берут в каталитических количествах:
Триметилфосфит и другие метилфосфиты в аналогичных условиях под действием кислот Льюиса претерпевают перегруппировку Арбузова в отсутствии метилгалогенидов:
В случае алкилирования другими алкилгалогенидами их берут в избыточном количестве, реакцию проводят при 100—160 °C, в случае низших алкилфосфитов (триметил-, триэтил- и т. п.) образующиеся в реакции низкокипящие галогениды отгоняют из реакционной смеси для предотвращения образования нецелевого фосфоната[4].
Использование кислот Льюиса позволяет снизить температуру реакции, так, например, в присутствии бромида цинка бензилгалогениды и их гетероциклические аналоги вступают в реакцию с триэтилфосфитом при комнатной температуре, образуя соответствующие фосфонаты с выходами 80—90 %, катализ ZnBr2 также позволяет использовать в качестве алкилирующих вместо бензилгалогенидов соответствующие бензиловые спирты с выходами фосфонатов в 75—85 %[5]:
Синтетическое применение
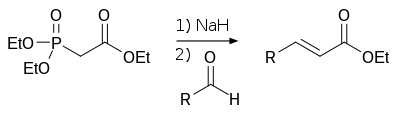
Фосфонаты с подвижными атомами водорода у метиленовой группы используются как субстрат при синтезе алкенов («олефинировании карбонильной группы») по Хорнеру-Уодсворту-Эммонсу
См. также
- Реакция Абрамова
- Реакция Перкова
Примечания
- Michaelis, A.; R. Kaehne. Ueber das Verhalten der Jodalkyle gegen die sogen. Phosphorigsäureester oder O-Phosphine (нем.) // Berichte der deutschen chemischen Gesellschaft : magazin. — 1898. — Bd. 31, Nr. 1. — S. 1048—1055. — ISSN 1099-0682. — doi:10.1002/cber.189803101190.
- Arbuzov, A. E. {{{заглавие}}} (неопр.) // J. Russ. Phys. Chem. Soc.. — 1906. — Т. 38. — С. 687.
- Arbuzov, A. E. {{{заглавие}}} (неопр.) // Chem. Zentr.. — 1906. — Т. II. — С. 1639.
- Nagata, W.; Wakabayashi, T.; Hayase, Y. Diethyl 2-(cyclohexylamino)vinylphosphonate. Organic Syntheses, Coll. Vol. 6, p.448 (1988); Vol. 53, p.44 (1973).
- Rajeshwaran, Ganesan Gobi; Meganathan Nandakumar, Radhakrishnan Sureshbabu, Arasambattu K Mohanakrishnan. Lewis Acid-Mediated Michaelis−Arbuzov Reaction at Room Temperature: A Facile Preparation of Arylmethyl/Heteroarylmethyl Phosphonates (англ.) // Organic Letters : journal. — 2011. — 18 March (vol. 13, no. 6). — P. 1270—1273. — ISSN 1523-7052 1523-7060, 1523-7052. — doi:10.1021/ol1029436.