Глюкозепан
Глюкозепан (англ. Glucosepane) — результат ковалентного поперечного сшивания лизина и аргинина производной от молекулы D-глюкозы[3], конечный продукт гликирования. Образует как внутримолекулярные, так и межмолекулярные необратимые сшивки коллагена во внеклеточном матриксе, а также кристаллина в хрусталике глаза[4], нарушая функционирование тканей. Глюкозепан встречается в тканях человека чаще, чем любой другой сшивающий конечный продукт гликирования, а его количество увеличивается с возрастом[5].
| Глюкозепан | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
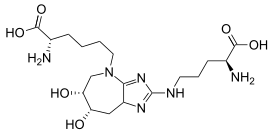
(2S)-2-амино-6-((6R, 7S)-2-(((S)-4-амино-4-карбоксибутил)амино)-6,7-дигидрокси-6,7,8,8a-тетрагидроимидазо[4,5-b] азепин-4(5H)-ил)гексановая кислота |
| Рац. формула | C18H32N6O6 |
| Физические свойства | |
| Молярная масса | 428,49 г/моль[1] |
| Плотность | 1,6 ± 0,1 г/см³[2] |
| Оптические свойства | |
| Показатель преломления | 1.693 |
| Классификация | |
| Рег. номер CAS | 257290-23-6 |
| PubChem | 124220628 |
| SMILES | |
| InChI | |
| ChemSpider | 26333276 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Был обнаружен Маркусом Ледерером и его коллегами в 1999 году в результате реакции N-бок-L-лизина, N-бок-L-аргинина и D-глюкозы, проходившей 8 недель при температуре 37 градусов[3][5].
Процесс образования
Глюкозепан образуется анаэробно в результате реакции Майяра. Взаимодействие лизина с D-глюкозой приводит к образованию нестабильного имина, известного как основания Шиффа, который затем реструктуризуется в более стабильный продукт Амадори. Далее продукт Амадори медленно преобразуется в глюкозепан через образование промежуточного α-дикарбонильного соединения.
Первоначально исследователи предполагали, что в α-дикарбонильном промежуточном соединении карбонилы расположены в локантах C-2 и C-3 молекулы D-глюкозы. Однако, пометив карбонил углерода в локанте C-1 изотопом 13С, исследователи обнаружили, что образованный α-дикарбонил содержал карбонилы, располагавшиеся в локантах C-5 и C-6 исходной молекулы D-глюкозы. Лучшее предположение состояло в том, что α-дикарбонил — N(6)-(2,3-дигидрокси-5,6-диоксогексил)-L-лизинат[6] — образуется из продукта Амадори через сдвиг карбонильных групп вниз по всему основному сахаросодержащему веществу через кето-енольную таутомерию с последующим удалением гидроксила в локанте C-4. Подтверждением предположения было исследование, в котором все атомы водорода в воде растворителя были заменены на атомы дейтерия. В результате после реакции все HC-OH оказались преобразованными в DC-OH, что свидетельствовало в пользу кето-енольной таутомерии.
Содержание в тканях
Наиболее активно у человека глюкозепан образуется во внеклеточном матриксе, достигая 2000 пмоль/мг к 100 годам. В хрусталике глаза интенсивность образования меньше — 400 пмоль/мг к 100 годам. У больного диабетом содержание глюкозепана в тканях может быть до 2-х раз выше, чем у здорового человека[5].
| Ткань | Субъект | Возраст субъекта | Уровень глюкозепана |
|---|---|---|---|
| Коллаген кожи | Человек | 100 лет | до 2000 пмоль/мг |
| 30—40 лет | 1500 пмоль/мг | ||
| Землекоп | 10 лет | 250 пмоль/мг | |
| Коллаген сухожилий | Крыса | 12 месяцев | 100 пмоль/мг |
| Кристаллин
хрусталика глаза |
Человек | 100 лет | до 400 пмоль/мг |
| Коллаген почек | Человек | Не увеличивается
с возрастом |
250 пмоль/мг |
| Сыворотка крови | Человек | 12—20 пмоль/мг |
См. также
Примечания
- PubChem
- ChemSpider — 2007.
- M. O. Lederer, H. P. Bühler. Cross-linking of proteins by Maillard processes--characterization and detection of a lysine-arginine cross-link derived from D-glucose // Bioorganic & Medicinal Chemistry. — 1999-6. — Т. 7, вып. 6. — С. 1081–1088. — ISSN 0968-0896.
- David R. Sell, Klaus M. Biemel, Oliver Reihl, Markus O. Lederer, Christopher M. Strauch. Glucosepane is a major protein cross-link of the senescent human extracellular matrix. Relationship with diabetes // The Journal of Biological Chemistry. — 2005-04-01. — Т. 280, вып. 13. — С. 12310–12315. — ISSN 0021-9258. — doi:10.1074/jbc.M500733200.
- Vincent M. Monnier, Wanjie Sun, David R. Sell, Xingjun Fan, Ina Nemet. Glucosepane: a poorly understood advanced glycation end product of growing importance for diabetes and its complications // Clinical Chemistry and Laboratory Medicine. — 2014-01-01. — Т. 52, вып. 1. — С. 21–32. — ISSN 1437-4331. — doi:10.1515/cclm-2013-0174.
- Klaus M. Biemel, D. Alexander Friedl, Markus O. Lederer. Identification and quantification of major maillard cross-links in human serum albumin and lens protein. Evidence for glucosepane as the dominant compound // The Journal of Biological Chemistry. — 2002-07-12. — Т. 277, вып. 28. — С. 24907–24915. — ISSN 0021-9258. — doi:10.1074/jbc.M202681200.
