Витронектин
Витронектин — гликопротеин массой 75 кДа, являющийся одним из основных белковых компонентов плазмы крови, а также присутствующий в моче, амниотической жидкости, межклеточном пространстве многих тканей и депонирующийся в тромбоцитах[1][2]. Он принимает участие в фибринолизе, опосредует клеточную адгезию и миграцию, ингибирует мембраноатакующий цитолитический комплекс системы комплемента и связывает некоторые серпины[3]. Также он играет роль в стимуляции пролиферации и роста клеток в таких процессах, как рост и метастазирование злокачественных опухолей, заживление ран и резорбция кости[4]. В циркулирующей крови витронектин представлен в двух изоформах: одноцепочечной и двухцепочечной, субъединицы которой соединены дисульфидной связью[5]. Синтез витронектина происходит главным образом в гепатоцитах, однако исследования показывают, что возможными источниками его могут быть нейроны центральной нервной системы, фоторецепторы и пигментный слой сетчатки[6], жировая ткань, миокард и скелетные мышцы[7].
| Витронектин (S-белок) | |
|---|---|
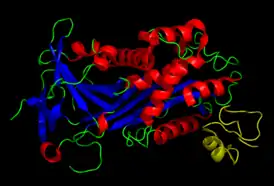 Соматомедин В-подобный домен витронектина (желтый) в комплексе с ингибитором активатора плазминогена-1. | |
| Обозначения | |
| Символы | VTN; V75; VN; VNT |
| Entrez Gene | 7448 |
| HGNC | 12724 |
| OMIM | 193190 |
| PDB | 1OC0 , 1s4g, 1ssu, 2jq8, 3bt1, 3bt2, 4k24 |
| RefSeq | NP_000629 |
| UniProt | P04004 |
| Другие данные | |
| Локус | 17-я хр. , 17q11.2 |
Витронектин получил своё имя за его способность адгезироваться на стекле[8]. В 70-х — ранних 80-х годах прошлого века проводились независимые друг от друга исследования различных свойств витронектина, которые, как полагалось, принадлежали разным белкам, известным как эпиболин (англ. epibolin), S-белок (англ. S-protein) и фактор распространения сыворотки (англ. serum spreading factor)[2]. Позднее в ходе экспериментов выяснилось, что объектом этих исследований был один и тот же белок и, соответственно, все вышеуказанные названия даны одному и тому же белку[9].
Структура
Витронектин представляет собой гликопротеин с молекулярной массой 75 кДа. Пептидная последовательность витронектина кодируется геном VTN, расположенным на длинном плече 17-й хромосомы[10]. Продуктом трансляции зрелого транскрипта этого гена является полипептид длиной в 478 аминокислотных остатков. Окончательная пептидная цепь витронектина имеет длину в 459 аминокислотных остатка и образуется путём отщепления от N-конца сигнальной последовательности длиной в 19 аминокислотных остатков. Альтернативный сплайсинг пре-мРНК для витронектина не выявлен[11]. Посттрансляционная модификация зрелой пептидной цепи включает гликозилирование по 86, 169 и 242 аспарагиновым остаткам[12], сульфатирование по Tyr75 и Tyr78 и фосфорилирование по Ser312[13]. В плазме крови витронектин существует в двух формах: одноцепочечной (массой 75 кДа) и двухцепочечной (в виде двух субъединиц с массой 65 и 10 кДа, объединенных дисульфидным мостиком между Cys274 и Cys453). Соотношение между этими двумя изоформами в плазме крови у разных людей различно и обусловлено полиморфизмом участка гена, кодирующего 381-й аминокислотный остаток. Вариабельный аминокислотный остаток (треонин либо метионин) предопределяет чувствительность полипептида к протеиназе, расщепляющей его между Arg379 и Ala 380. Чувствительность витронектина с метионином в 381-й позиции к соответствующей протеиназе выше, чем с треонином[14].
В структуре белка различают следующие домены:
- N-терминальный соматомедин B-подобный домен (Asp1- Thr44, 44 а.о.)[15] — отвечает за связывание с ингибитором активатора плазминогена-1 (англ. Plasminogen activator inhibitor-1, PAI-1) и урокиназным рецептором. Содержит четыре дисульфидных связи, восстановление которых значительно снижает сродство витронектина к PAI-1[16].
- RGD-последовательность (Arg45 — Asp47, 3 а.о.) — последовательность из трех аминокислотных остатков (Arg, Gly и Asp), необходимая для связывания с интегриновыми рецепторами на поверхности клеток[17].
- Гемопексин-подобные домены (Ala132-Leu459) — два домена, гомологичных доменам гемопексина[18]. Гемопексин — один из гликопротеинов, связывающих и транспортирующих гем. В его структуре различают два домена, каждый из которых содержит четыре гомологичных повтора. Витронектин содержит в своей структуре 5 таких повторов[19]. Гемопексиновые домены позволяют ему связываться с сульфатидами, фосфатидилсерином, холестерол-3-сульфатом, коллагеном 1-го типа и β-эндорфинами[20]. Гемопексиновые повторы также узнаются бактериями S.pyogenes, в результате последние могут связываться с витронектином, получая таким образом защиту от системы комплемента и облегчая себе прикрепление к клеткам хозяина[21].
- Гепарин-связывающие домены — два гепарин-связывающих участка внутри гемопексиновых повторов (Asp82-Cys137 и Lys175-Asp212), а также основной участок связывания гликозаминогликанов (Ala341-Ala380). Последний, помимо гепарина, связывает также остеонектин, PAI-1, комплексы системы комплемента, плазминоген и коллаген[22]. Ещё один коллаген-связывающий участок локализуется ближе к N-концу, рядом с RGD-последовательностью[23].
Функции
Иммунный ответ
Витронектин влияет на каскад реакций образования мембраноатакующего комплекса системы комплемента — одного из механизмов врожденного иммунитета. Он связывается с C5b-7 комплексом, после чего образование терминального мембраноатакующего комплекса не может быть осуществлено[24]. Он также ингибирует полимеризацию белка С9 системы комплемента, препятствуя тем самым образованию литической поры в мембране атакуемой клетки[25].
Фибринолиз
Витронектин способен регулировать активацию плазминогена. Он имеет два участка связывания с ингибитором активатора плазминогена-1 (PAI-1). Главный из них расположен с N-конца — соматомедин В-подобный домен. С помощью него витронектин связывает и стабилизирует молекулу PAI-1[26]. Это избавляет соответствующие сериновые протеазы — активаторы плазминогена, например, урокиназу — от ингибирующего влияния и позволяет им беспрепятственно расщепить плазминоген, превратив его в активную форму — плазмин, и тем самым активировать процесс фибринолиза.
Коагуляция
Витронектин способен связывать гепарин — гликозаминогликан, одной из функций которого является опосредование взаимодействия антитромбина III с тромбином, ведущее к деактивации последнего. Связывание гепарина витронектином ингибирует его каталитическую функцию, снижая скорость инактивации тромбина[27].
Адгезия и миграция клеток
RGD-последовательность в составе витронектина позволяет ему взаимодействовать с интегриновыми рецепторами. Интегриновые рецепторы — гетеродимеры, состоящие из одной α- и одной β-субъединицы[28]. Витронектин способен связываться с αV-интегринами и интегрином αIIβ3. Взаимодействуя с интегриновыми рецепторами на поверхности клеток, витронектин способствует адгезии клеток к внеклеточному матриксу и их миграции[29], способствуя тем самым заживлению ран, росту злокачественных новообразований и их метастазированию[2].
Роль в патологии
Витронектин, обладая широким спектром физиологических функций, вовлечен в ряд патологических процессов. Так, обнаружена повышенная степень его отложения в стенках атеросклеротических сосудов[30]. Исследования показывают, что витронектин участвует в образовании амилоидных бляшек[31]; его накопление определяется в амилоидных отложениях при болезни Альцгеймера[32], кожном амилоидозе[33], АА-амилоидозе[34] и возрастной макулярной дегенерации[35]. Уровень витронектина в плазме из-за нарушения синтеза снижен при многих заболеваниях печени и может использоваться как маркер синтетической функции этого органа[36] ; в то же время, при фиброзах печени различной этиологии и степени наблюдается значительное повышение концентрации витронектина в печеночной ткани[37]. Он играет роль также и в развитии фиброзов других органов[38].
См. также
Примечания
- «Structural and functional characteristics of vitronectin and its role in haemostasis» Zhernossekov D. D., Zolotareva E. N. Biopolym. Cell. 2011; 27(4):258-263.
- Robert Mecham. The Extracellular Matrix: an Overview. — Springer Science & Business Media, 2011. — 440 p. — ISBN 9783642165559
- «Vitronectin» Schvartz I, Seger D, Shaltiel S. Int J Biochem Cell Biol. 1999 May;31(5):539-44.
- «Vitronectin and its receptors» Felding-Habermann B, Cheresh DA. Curr Opin Cell Biol. 1993 Oct;5(5):864-8.
- «Role of vitronectin and its receptors in haemostasis and vascular remodeling» Preissner KT, Seiffert D. Thromb Res. 1998 Jan 1;89(1):1-21.
- «Vitronectin gene expression in the adult human retina» Anderson DH, Hageman GS, Mullins RF, Neitz M, Neitz J, Ozaki S, Preissner KT, Johnson LV. Invest Ophthalmol Vis Sci. 1999 Dec;40(13):3305-15.
- «Vitronectin gene expression in vivo. Evidence for extrahepatic synthesis and acute phase regulation» Seiffert D, Crain K, Wagner NV, Loskutoff DJ. J Biol Chem. 1994 Aug 5;269(31):19836-42.
- «Serum spreading factor (vitronectin) is present at the cell surface and in tissues» Hayman EG, Pierschbacher MD, Ohgren Y, Ruoslahti E. Proc Natl Acad Sci U S A. 1983 Jul;80(13):4003-7.
- «Physicochemical, immunochemical and functional comparison of human S-protein and vitronectin. Evidence for the identity of both plasma proteins» Preissner KT, Heimburger N, Anders E, Müller-Berghaus G. Biochem Biophys Res Commun. 1986 Jan 29;134(2):951-6.
- «The human vitronectin (complement S-protein) gene maps to the centromeric region of 17q» Fink TM, Jenne DE, Lichter P. Hum Genet. 1992 Mar;88(5):569-72.
- K. Rother, Gerd Till, Gertrud M. Hänsch. The Complement System. — Springer Science & Business Media, 1998. — 564 p. — ISBN 3540618945
- «Glycoproteomics analysis of human liver tissue by combination of multiple enzyme digestion and hydrazide chemistry» Chen R, Jiang X, Sun D, Han G, Wang F, Ye M, Wang L, Zou H. J Proteome Res. 2009 Feb;8(2):651-61. doi: 10.1021/pr8008012.
- «Determination of the sites of tyrosine O-sulfation in peptides and proteins» Yu Y, Hoffhines AJ, Moore KL, Leary JA. Nat Methods. 2007 Jul;4(7):583-8. Epub 2007 Jun 10.
- «The presence of methionine or threonine at position 381 in vitronectin is correlated with proteolytic cleavage at arginine 379» Tollefsen DM, Weigel CJ, Kabeer MH. J Biol Chem. 1990 Jun 15;265(17):9778-81.
- «Structural and functional characterization of vitronectin-derived RGD-containing peptides from human hemofiltrate» Ständker L1, Enger A, Schulz-Knappe P, Wohn KD, Germer M, Raida M, Forssmann WG, Preissner KT. Eur J Biochem. 1996 Oct 15;241(2):557-63.
- «Functional structure of the somatomedin B domain of vitronectin» Zhou A. Protein Sci. 2007 Jul;16(7):1502-8. Epub 2007 Jun 13.
- «Arginyl-glycyl-aspartic acid (RGD): a cell adhesion motif» D’Souza SE, Ginsberg MH, Plow EF. Trends Biochem Sci. 1991 Jul;16(7):246-50.
- «A domain structure common to hemopexin, vitronectin, interstitial collagenase, and a collagenase homolog» Hunt LT, Barker WC, Chen HR. Protein Seq Data Anal. 1987;1(1):21-6.
- «Hemopexin domains as multifunctional liganding modules in matrix metalloproteinases and other proteins» Piccard H, Van den Steen PE, Opdenakker G. J Leukoc Biol. 2007 Apr;81(4):870-92. Epub 2006 Dec 21.
- «Characterization of the ligand binding activities of vitronectin: interaction of vitronectin with lipids and identification of the binding domains for various ligands using recombinant domains» Yoneda A1, Ogawa H, Kojima K, Matsumoto I. Biochemistry. 1998 May 5;37(18):6351-60.
- «The hemopexin-type repeats of human vitronectin are recognized by Streptococcus pyogenes» Liang OD, Preissner KT, Chhatwal GS. Biochem Biophys Res Commun. 1997 May 19;234(2):445-9.
- «Identification of novel heparin-binding domains of vitronectin» Liang OD, Rosenblatt S, Chhatwal GS, Preissner KT. FEBS Lett. 1997 Apr 28;407(2):169-72.
- «Two collagen-binding domains of vitronectin» Ishikawa-Sakurai M, Hayashi M. Cell Struct Funct. 1993 Aug;18(4):253-9.
- «Characterization of human S protein, an inhibitor of the membrane attack complex of complement. Demonstration of a free reactive thiol group» Dahlbäck B, Podack ER. Biochemistry. 1985 Apr 23;24(9):2368-74.
- «Formation of the terminal complement complex on agarose beads: further evidence that vitronectin (complement S-protein) inhibits C9 polymerization» Johnson E, Berge V, Høgåsen K. Scand J Immunol. 1994 Mar;39(3):281-5.
- «How vitronectin binds PAI-1 to modulate fibrinolysis and cell migration» Zhou A, Huntington JA, Pannu NS, Carrell RW, Read RJ. Nat Struct Biol. 2003 Jul;10(7):541-4.
- «S protein modulates the heparin-catalyzed inhibition of thrombin by antithrombin III. Evidence for a direct interaction of S protein with heparin» Preissner KT, Müller-Berghaus G. Eur J Biochem. 1986 May 2;156(3):645-50.
- Integrins: bidirectional, allosteric signaling machines Hynes RO. Cell. 2002 Sep 20;110(6):673-87.
- «The serpin PAI-1 inhibits cell migration by blocking integrin alpha V beta 3 binding to vitronectin» Stefansson S, Lawrence DA. Nature. 1996 Oct 3;383(6599):441-3.
- «Localization of vitronectin in the normal and atherosclerotic human vessel wall» van Aken BE, Seiffert D, Thinnes T, Loskutoff DJ. Histochem Cell Biol. 1997 Apr;107(4):313-20.
- «Formation of soluble amyloid oligomers and amyloid fibrils by the multifunctional protein vitronectin» Shin TM, Isas JM, Hsieh CL, Kayed R, Glabe CG, Langen R, Chen J. Mol Neurodegener. 2008 Oct 21;3:16. doi: 10.1186/1750-1326-3-16.
- «Immunohistochemical localization of vitronectin, its receptor and beta-3 integrin in Alzheimer brain tissue» Akiyama H, Kawamata T, Dedhar S, McGeer PL. J Neuroimmunol. 1991 Apr;32(1):19-28.
- «Immunohistochemical studies on vitronectin in elastic tissue disorders, cutaneous amyloidosis, lichen ruber planus and porphyria» Dahlbäck K, Löfberg H, Dahlbäck B. Acta Derm Venereol. 1988;68(2):107-15.
- Immunohistochemical demonstration of vitronectin in association with elastin and amyloid deposits in human kidney Dahlbäck K, Löfberg H, Dahlbäck B. Histochemistry. 1987;87(6):511-5.
- «Complement activation and inflammatory processes in Drusen formation and age related macular degeneration». Johnson LV, Leitner WP, Staples MK, Anderson DH. Exp Eye Res. 2001 Dec;73(6):887-96.
- «Vitronectin in liver disorders: biochemical and immunohistochemical studies» Inuzuka S, Ueno T, Torimura T, Tamaki S, Sakata R, Sata M, Yoshida H, Tanikawa K. Hepatology. 1992 Apr;15(4):629-36.
- «Vitronectin in the cirrhotic liver: an immunomarker of mature fibrosis» Koukoulis GK1, Shen J, Virtanen I, Gould VE. Hum Pathol. 2001 Dec;32(12):1356-62.
- «Vitronectin (serum spreading factor): its localisation in normal and fibrotic tissue» Reilly JT, Nash JR. Lab Invest. 2014 Jun;94(6):633-44. doi: 10.1038/labinvest.2014.51. Epub 2014 Mar 31.
Литература
- Robert Mecham. The Extracellular Matrix: an Overview. — Springer Science & Business Media, 2011. — 440 p. — ISBN 9783642165559
- Alan D. Michelson. Platelets. — Academic Press, 2012 — p. 408 — ISBN 9780123878373
- Roy Zent, Ambra Pozzi. Cell-Extracellular Matrix Interactions in Cancer. — Springer Science & Business Media, 2010. — Ch.7: Vitronectin-binding integrins in cancer. — ISBN 9781441908148
- R. K. Freinkel, D.T. Woodley. The Biology of the Skin. — CRC Press, 2001. — p. 337-338. — ISBN 1850700060