Ботвиник, Мария Моисеевна
Мария Моисеевна Ботвиник (реже встречается написание Ботвинник; 23 октября 1901, Минск — 17 апреля 1970, Москва[1]) — советский химик-органик, доктор химических наук, учёный, специалист в области химии белка, в частности, оксиаминокислот . Впервые в России синтезировала важнейшие оксиаминокислоты и их производные, значительно продвинула химию в решении вопроса о роли гидроксила в белке, механизмах действия ферментов.
| Мария Моисеевна Ботвиник | |
|---|---|
| Дата рождения | 23 октября (5 ноября) 1901 |
| Место рождения | Минск |
| Дата смерти | 17 апреля 1970 (68 лет) |
| Место смерти | Москва, СССР |
| Страна | |
| Научная сфера | Химия, Биология |
| Место работы | МГУ им. М.В.Ломоносова |
| Альма-матер | Физико-математический факультет МГУ |
| Учёная степень | доктор химических наук |
| Учёное звание | доцент |
| Научный руководитель | Зелинский Николай Дмитриевич, Гаврилов Николай Иванович |
Биография
Родилась в еврейской семье. Отец был служащий (управляющий фабрикой).
В 1918 г. окончила 88-ю трудовую школу в Москве. В 1918-23 гг. служила в Наркомпроде, затем в Хлебопродукте в должности конторщика, делопроизводителя, заведующей отделением, секретаря отдела, корреспондента. В 1924—1925 гг. преподавала естествознание и экономическую географию в средней школе 34.
В 1919 г. поступила на физико-математический факультет МГУ и в 1927 г. окончила Химическое отделение, защитив дипломную работу «Об ангидридном комплексе эдестина, содержащем гексониевые основания» (1929г)[2]. В 1928—1929 г. работала препаратором и лаборантом Химического отделения . В 1929—1931 гг. — в аспирантуре химфака (научный руководитель Н. Д. Зелинский). После окончания аспирантуры в 1931 г. была оставлена работать на Химфаке МГУ ассистентом, преподавала органическую химию. Научную работу вела в лаборатории химии белка, руководителем которой был Н. Д. Зелинский, а заместителем Н. И. Гаврилов. Одновременно работала старшим научным сотрудником биохимического Института им. Баха. В 1935 г защитила кандидатскую диссертацию и получила звание доцента кафедры органической химии. Хорошо владела тремя языками: французским, английским, немецким. В 1941 г. эвакуировалась вместе с университетом в Ашхабад, где наряду с МГУ работала старшим научным сотрудником в Туркменском филиале АН СССР. В 1956 г защитила диссертацию на степень доктора химических наук. Имеет более 50 печатных работ. С 1967 г — старший научный сотрудник кафедры химии природных соединений Химфака МГУ. Более 20 лет Мария Моисеевна читала спецкурс для студентов, специализирующихся в области химии белка. Будучи эрудированным ученым в области органической химии, прекрасным лектором и педагогом, она пользовалась заслуженным авторитетом среди сотрудников и студентов Химического факультета.
Мария Моисеевна активно участвовала в общественной работе: до 1929г была библиотекарем на фармзаводе № 2. В 1929—1934 г на выборной работе: секретарём месткома; заведующей производственным сектором; членом вузовско-аспирантского бюро; председателем местного аспирантского бюро, секретарём бюро секции научных работников (СНР), агитатором студенческих групп. Была членом вузбюро СНР по шефству над кавалерийской бригадой.
Награды: медаль «За трудовую доблесть во время Великой Отечественной войны» (1946г), многочисленные почётные грамоты и благодарности за общественную, педагогическую и научную работы от руководства химического факультета и Университета (1931—1941 гг.).
12 января 1970 г. была уволена с должности в связи с уходом на пенсию[3].
Научная деятельность
Мария Моисеевна в различные периоды становления науки о белках занималась актуальными проблемами химии белков и пептидов, изучением структуры и свойств производных аминокислот. В начале своей научной деятельности, будучи ещё аспиранткой у Гаврилова Н. И. она изучала и дополняла вместе с ним дикетопиперазиновую теорию строения белка. В рамках этой теории исследовались ангидридные комплексы, об одном из которых (выделенном из белка эдестина) была опубликована статья, дискуссионного характера, содержащая ценную информацию, отражающую представления о строении белков в России и во всём мире на момент её написания (1929 г). [2]
Дикетопиперазины составляли важное направление
ранних исследований Ботвиник, они упоминаются и в статье «К вопросу о
лактам-лактамной перегруппировке» (1937)[4]. В этой работе решена проблема неопределенности формы амидов путём определения двойной связи по углерод-азоту, так как последняя специфична только для лактимной перегруппировки. В качестве метода для изучения перегрупировки амидной связи была использована реакция Прилежаева: действие пербензойной кислоты на двойную связь.
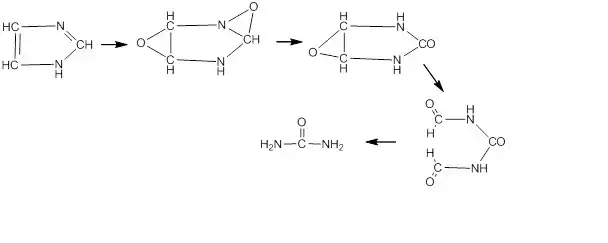
Заинтересовавшись пербензойной кислотой, М.М. Ботвиник уже со своими коллегами и учениками стала расширять исследования, чтобы понять, насколько глубоко и по какому механизму идет окисление этой кислотой. Дело в том, что использование пербензойной кислоты в качестве реактива для качественного, а тем более количественного определения двойной связи углерод-азот требовало более детального изучения характера окисления. С одним из своих первых студентов, М.А. Прокофьевым, они изучили окисление этим реактивом имидазола и его производных. Имидазольное кольцо было удобно для данного исследования, так как оно является очень стабильным. Кроме того, эта группировка широко распространена в белке. Соотношение азотосодержащих соединений было практически не изучено [5]. В данной работе был выяснен механизм окисления имидазольного кольца. Окисление шло через стадию двуокиси и приводило к мочевине:
Несмотря на то, что дикетопиперазиновая теория развивалась вплоть до конца 40-х годов ХХ века, М. М. довольно быстро поняла ложность этой теории и осталась преверженицей пептидной теории Э. Фишера, которую она преподавала студентам и ученикам. Дальнейшая работа М. М. была посвящена оксиаминокислотам, в особенности серину. Область оксиаминокислот привлекала в 40-е г. внимание многих исследователей. Выделение из белков треонина, эфиров фосфорной кислоты с оксиаминокислотами, данные о значении гидроксильной группы при ферментативном расщеплении белка показывали, что оксигруппа, а, следовательно, и оксиаминокислоты играют определенную и, может быть, немаловажную роль в белках.
Но знания об этой группе аминокислот в 1930-е годы были довольно скудными. Особенно мало было известно об оксиаминокислотах жирного ряда. В связи с этим возникали трудности выделения и определения этих соединений. Вполне доказанными в белке можно было считать: тирозин, оксипролин, серин, треонин и b-оксиглютаминовую кислоту. Данные об b-оксивалине, оксилизине, окситрептофане и ряде других требовали подтверждения. Так, треонин, впервые упоминаемый В. С. Садиковым и Н. Д. Зелинским[6] в 1923г, был окончательно доказан в белках только в 1935г после выделения из фибрина крови.
В поисках специфичных особенностей оксиаминокислот Ботвиник и её группа остановились на реакции дегидратации, характерной для b-оксикислот. Однако при подходе к исследованиям они столкнулись с не разработанностью методов синтеза оксиаминокислот.
Было установлено, что наилучшим и универсальным методом синтеза b-окси-a-аминокарбоновых кислот является синтез треонина из кротоновой кислот. Он заключается в реакции непредельной кислоты с ацетатом ртути в растворе метилового спирта. После аминирования аммиаком и отщепления метоксигруппы бромистоводородной кислотой образуется b-окси-a-аминокислота.
Далее была найдена характерная реакция для b-окси-a-аминокарбоновых кислот жирного ряда — дегидратация бензойным ангидридом с образованием ненасыщенных азалактонов. Установлено, что дегидратация происходит после предварительной циклизации. Так же был изучен гидролиз азалактонов до ацилов непредельных аминокислот.[7]
Реакция дегидратации представляла двоякий интерес. С одной стороны эта реакция должна быть характерна только для оксиаминокислот, с другой — не исключена возможность, что именно таким путём идёт распад оксиаминокислот, если не in vivo, то in vitro. Из различных деградационных средств исследователи остановились на бензойном ангидриде как на сравнительно мягком реагенте. В работах М. М. Ботвиник и сотр. прослеживается направление подбора условий для улучшения выхода азалактона: времени, температуры режима и характера обработки исходных веществ.
В 1940-е М. М. Ботвиник удалось осуществить синтез b-оксинорвалина и выяснить механизм реакции получения этого вещества[8]. А в 1948 г. Мария Моисеевна разработала качественные реакции на b-оксиаминокислоты и серин[9]. Основой для этой реакции явилась способность оксиаминокислот при нагревании с уксусным или бензойным ангидридом переходить в ненасыщенные азалактоны. Появляющуюся двойную связь можно легко обнаружить обесцвечиванием перманганата по Байеру. Образующиеся ненасыщенные азалактоны малоустойчивы и при нагревании разлагаются до соответствующих кетокислот. В случае серина образуется пировиноградная кислота, которая с силициловым альдегидом в щелочной среде дает оранжево-коричневую окраску. Таким путём можно определять положение серина в пептиде. Из всех аминокислот, встречающихся в белках, обе реакции дает только цистеин, который подобно оксиаминокислотам, превращается в ненасыщенный азалактон.
Также Ботвиник многие годы посвятила исследованиям реакций с пербензойной кислотой. Её работы подтвердили на ряде примеров активность углерод-азотной двойной связи. Одновременно с этим было найдено, что жирные амины, подобно ароматическим, окисляются пербензойной кислотой и что способность азотсодержащей группы вступать в реакцию связана с наличием свободных электронов у азота. Доказано, что кислые свойства соединений понижают их реакционную способность[10]. В 1946г вышла статья, в которой совместно с академиком Н. Д. Зелинским Мария Моисеевна восполняют пробелы в данных по содержанию оксиаминокислот в белках[11].
В 1951 г в Учёных записках МГУ, посвященных 90-летию Н. Д. Зелинского, была опубликована статья, где излагались многие ценные представления относительно специфики свойств белков. Показано, что оксигруппа в ряде изученных белков доминирует либо составляет значительную часть полярных функциональных групп белка. Данное исследование позволило значительно продвинуться в решении вопроса о роли гидроксила в белке. С целью выяснения возможных путей подхода к изучению роли гидроксила в белке М. М. и сотрудники исследовали реакционную способность гидроксила в оксиаминокислотах, в частности, по отношению к оксизалонам; поставили при этом и вторую цель — получение эфирной связи аминокислоты, по оксигруппе. Высокое содержание оксиаминокислот в ряде белков, в частности, в фибриллярных белках, выявило, что гидроксил играет особую специфическую роль, образуя лабильные связи в белках или между белками. В качестве экспериментального подхода Ботвиник пробовала применить для обнаружения эфирной связи гидроксамовую реакцию. Оказалось, если проводить последнюю в строго выбранных условиях, то реагирует только эфирная связь. С помощью гидроксамовой реакции стало возможно разрешить интересную и важную проблему о форме связи гидроксила в белковой молекуле[12].
Продолжались работы и по изучению свойств эфирной связи, образованной аминокислотой и гидроксильной группой b-оксиаминокислоты. Авторы полагали, что изучение наряду с амидообразной других форм связи, в том числе эфирной, имеет существенное значение для разрешения вопроса строения белка. Для этой цели в 1953 г. были разработаны методы синтеза и получены N, O-пептиды серина, а также изучено их отношение к ферментам. В качестве ферментов использовались панкреатин и кристаллический трипсин, а позднее пепсин и папаин. Среди полученных соединений: О-(бензоилфенилаланин)-N-бензоилсерин, этиловый эфир О-(бензоиламиноизобутирил)-N-бензоилсерина, изопропиловый эфир N, O-ди-(фталилглицил)-серина и метиламид О-(бнзоилфенилаланил)-N-бензоилсерина[13].
В 1953 г Ботвиник впервые были синтезированы ряд эфиров и амидов, ацилированных пептидов серина. Среди них: изопропиловый эфир N-(фталилглицил)-серина с выходом 72 %, метиловый эфир N-(фталилглицил)-серина — 54 %, метиловый эфир N-(п-толуолсульфоглицил)-серина — 46 %, метиловый эфир N-(бензоилфенилаланил)-серин — 71 %. Последний в виде двух стереомеров. Метиловые эфиры действием метиламина превращались в соответствующие амиды N-ацильных производных пептидов серина[14].
Таким образом, был решен вопрос о возможности образования О-пептидной связи по гидроксилу серина, разработаны условия и синтезирован ряд N, О-пептидов серина, N-бензоил-О-пептидов серина и их производных. Далее в 1955г, вместе с уже упомянутой С. М. Аваевой, М. М. Ботвиник принялась за оксиаминокислоту треонин. Были синтезированы N-ацил-О-пептидов треонина и аллотреанина[15]. На примере этих соединений в последующих работах изучена возможность ферментативного гидролиза О-пептидной связи в пептидах треонина, что явилось переходом к новому направлению в исследованиях — к ферментативным синтезам. В 1958 г. М. М. Ботвиник опубликовала статью «Ферментативный синтез оптически деятельных пептидов из гликолевых эфиров D, L-аминокислот». Оказалось, что ферментативный гидролиз гликолевых эфиров ациламинокислот можно использовать для разделения ацил-D, L-аминокислот на оптические антиподы[16]. В 1964г с помощью метода ИК-спектроскопии была выявлена причина появления рацемизации, наблюдающейся при синтезе нитрофениловых эфиров карбобензоксипептидов карбодиимидным методом. Появление такой рацемизации явилось следствием азалактонизации пептидов[17].
В качестве продолжения изучения переноса аминокислотных остатков с О-пептидов b-аминокислот на белки с помощью метода радиоактивных изотопов М. М. Ботвиник и А. П. Андреевой был синтезирован N-бензоил-(О-бензоилфенилаланил-С14)-серин, который в дальнейшем под действием химотрипсина взаимодействовал с альбумином сыворотки крови и отдельно с инсулином[18]. Устойчивость полученных препаратов к щелочи позволила предположить, что присоединение идёт за счёт образования стабильных пептидных связей. Это предположение в дальнейшем продолжали развивать. Так, в том же году Мария Моисеевна проводила аналогичную реакцию с рибонуклеазой[19]. Оказалось, что рибонуклеаза способна сама активировать процесс переноса бензоилфенилаланила на белок, а химотрипсин в этой реакции является своего рода ингибитором.
В конце 60-х г. Марией Моисеевной и её коллегами для изучения ферментов стали широко применяться хромогенные субстраты. При работе с протеиназами хорошо зарекомендовали себя нитроанилиды аминокислот. Они использовались как в теоретических исследованиях, так и в медицине для диагностики различных заболеваний. Как синтетические субстраты п-нитроанилиды заинтересовали учёных ещё в довоенные годы. Однако синтез этих соединений представлял некоторые трудности. Особенно сложно было получить оптически чистые и одновременно легко растворяющиеся субстраты. Поэтому М. М. Ботвиник и Е. В. Раменским был разработан метод получения оптически чистых n-нитроанилидов ацетил-L-лейцина и ацетил-L-фенилаланина[20].
Параллельно, начиная с 1964 г, М. М. Ботвиник и С. М. Аваеву привлекали вопросы строения фосфопротеидов, в частности выяснения характера связи фосфорной кислоты с белком. Макроэргический характер фосфорных связей в фосфоропротеинах, их большая лабильность, высокая реакционная способность и ряд других особенностей позволяли предполагать наличие в фосфопротеинах различных форм связей. Основываясь на предположении о существовании в белках, помимо моноэфирной, ещё и пирофосфатных связей, исследователями под руководством Марии Моисеевны были получены 2 соединения, которые являлись представителями нового класса дисерилпирофосфатов: Р1Р2-ди(бензиловый эфир N-карбобензоксисерил)-Р1Р2-дибензилпирофосфат и Р1Р2-ди(метиламид N-бензоилсерил)-Р1Р2-дибензилпирофосфат. В дальнейшем проводилось подробное изучение свойств данных соединений[21]. Работы в этих направлениях стали продолжаться в 1970-х годах коллегами и сподвижниками Марии Моисеевны. Например, в работах по изучению серилпирофосфатов типа I Аваевой была изучена устойчивость этих соединений при различных рН, кинетика их кислотного гидролиза, ферментативный гидролиз неорганической пирофосфатазой дрожжей и щелочной фосфатазой E. Coli[22].
Личная жизнь
М. М. Ботвиник не имела семьи, посвящая всю жизнь работе в университете. При наличии несомненного таланта исследователя ей не удалось достичь соответствующих её квалификации должностей (в частности, должности профессора), и этому был ряд причин: в частности, М. М. не была членом партии; некоторые её родственники после революции проживали за границей, что также осложняло социальный статус в тот период времени. С 1940-х гг. проживала в коммунальной квартире по адресу ул. Чкалова, д. 7, кв. 5.
Ссылки
Примечания
- Мария Моисеевна Ботвинник
- Gawrilow N. J., Botwinic M. M. Uber einen Anhydridkomplex aus Edestin, der die Hexonbasen enthalt // Biochemische Zeitschrift, 1929, v. 214, p. 119.
- Архив Химфака МГУ, Ф. 4, оп. 10л, д. Ботвиник, 58 л.
- Ботвиник М. М., Гаврилов Н. И.К вопросу о лактам-лактамной перегруппировке //ЖОХ, 1937, 7, 1614.
- Ботвиник М.М., Прокофьев М.А. Окисление имидазола и его производных пербензойной кислотой //ЖОХ, 1937, 7, 1621-1628.
- Садиков В. С., Зелинский Н. Д. // Biochem., Z., 1923, 143.
- Ботвиник М. М., Прокофьев М. А., Морозова Е. А. //Уч. записки МГУ, 1941, в. LXXII, 245.
- Ботвиник М. М., Морозова Е. А., Самсонова Г. // ДАН СССР, 1941, 30, № 2, 132
- Ботвиник М. М., Глухман Г. Я., Северин И. С., //ДАН СССР, 1948, 63, № 3, 269.
- Ботвиник М. М. //ЖОХ, 1946, 16, № 6, 863.
- Ботвиник М. М., Нерсесова Н. Е., //ДАН СССР, 52, № 5, 433.
- Ботвиник М. М., Аваева С. М., Одинец В., Яшунский В., Уч. записки МГУ, в. 151, 323, (1951)
- Ботвиник М. М., Аваева С. М., Мистрюков Э. А. //ЖОХ, 23, 971, 1953
- Ботвиник М. М., Аваева С. М., Мистрюков Э. А. //ЖОХ, 23, 1716, 1953
- Ботвиник М. М., Аваева С. М., Мистрюков Э. А. //ЖОХ, 26, 2329, 1956
- Ботвиник М. М., Остославская В, Иванов Л. //ЖОХ, 31, 42, 1961
- М. М. Ботвиник, С. Н. Карра-Мурза, С. М. Аваева//ДАН СССР, 1964, 156, 88
- Ботвиник М. М., Андреева А. П., ДАН СССР, 133, 98, 1960
- Ботвиник М. М., Андреева А. П., ДАН СССР, 133, 359, 1960
- Ботвиник М. М., Раменский //Вестник Московского Университета, 1966, № 5
- Аваева С. М., Ботвиник М. М., Сыромятникова И. Ф., Григорович В. И. //Вестник Московского Университета, 1965, № 3
- Аваева С. М., Карра-Мурза С. Н., Ботвиник М. М. //ХПС, 1967, № 5, 328