Бергаптен
Бергаптен (5-метоксипсорален) — это встречающееся в природе органическое химическое соединение, вырабатываемое многочисленными видами растений, особенно из подсемейства Сельдерейных семейства Зонтичные и подтрибы Цитрусовых семейства Рутовые. Например, бергаптен был извлечен из 24 видов растений рода Борщевик в семействе Зонтичные[1][2]. В семействе Рутовые различные виды цитрусовых содержат значительное количество бергаптена[3] особенно растение группы Папеда, называемое Цитрусовой микрантой, Бергамот оранжевый (C. bergamia), а также некоторые сорта лайма и горького апельсина.
| Бергаптен | |
|---|---|
 _-_3D_-_Ball-and-stick_Model.png.webp) | |
| Общие | |
| Систематическое наименование |
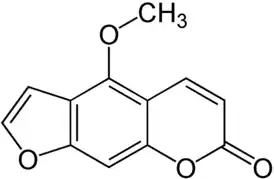
4-метокси-7H-фуро[3,2-g]хромен-7-он |
| Традиционные названия | 5-метоксипсорален |
| Хим. формула | C12H8O4 |
| Физические свойства | |
| Состояние | твёрдое, кристаллическое |
| Молярная масса | 216 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 139—191 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | не растворимо |
| • в хлороформе | хорошо растворимо |
| • в этиловом спирте | растворимо |
| Классификация | |
| Рег. номер CAS | 484-20-8 |
| PubChem | 2355 |
| Рег. номер EINECS | 207-604-5 |
| SMILES | |
| InChI | |
| RTECS | LV1300000 |
| ChEBI | 18293 |
| ChemSpider | 2265 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Бергаптен принадлежит к классу химических соединений, известных как фуранокумарины. В 1834 году Кальбруннер выделил 5-метоксипсорален из эфирного масла бергамота[4] отсюда и общее название «бергаптен». Это был первый фуранокумарин, который был выделен и идентифицирован.
Токсичность
Бергаптен является производным псоралена, родительского соединения целого семейства природных органических соединений, известных как линейные фуранокумарины[* 1]. Некоторые из них, включая бергаптен, действуют как сильные фотосенсибилизаторы при местном нанесении на кожу.
Бергаптен часто встречается в растениях, вызывающих фитофотодермит[5] — потенциально серьезное воспаление кожи. Контакт с частями растений, содержащими бергаптен (и другие линейные фуранокумарины), при последующем воздействии ультрафиолетового света может привести к фитофотодерматиту. В частности, бергаптен, по-видимому, является основным фототоксичным соединением, ответственным за вызванный цитрусовыми фитофотодермит[3].
Бергаптен и другие линейные фуранокумарины вызывают потерю активности для синтеза РНК На матрице ДНК. 5-метоксипсорален также известен своими мутагенными эффектами, и своей способностью быть очень сильным агентом для индукции хромосомных аберраций. При достаточно высокой концентрации наблюдалось полное митотическое ингибирование[4].
Существует достаточно доказательств того, что бергаптен способствует развитию рака у животных, но таких доказательств канцерогенности у людей нет. По данным Международного агентства по изучению рака, бергаптен, вероятно, канцерогенен для человека[6].
Медицинское использование
Бергаптен помогает коже поглощать больше света, поэтому он используется (вместе с другими фуранокумаринами) при пигментных заболеваниях, таких как витилиго (лейкодермия) и псориаз, часто в сочетании с воздействием солнца или солнечной радиации. У людей, которые легко обгорают, фуранокумарины могут также повышать устойчивость кожи к солнечному излучению[4]. Было показано, что бергаптен вызывает определенные кожные реакции для выравнивания осветления пигментации у пациентов с витилиго в зависимости от различных факторов, таких как восприимчивость субъекта, дозировка и влажность, но иногда эффекты могут быть несовместимыми[7].
При псориазе бергаптен ценится как пероральное фотохимиотерапевтическое средство из-за его эффективности, отсутствия фототоксических реакций и проявлений лекарственной нечувствительности. Он действует как фотосенсибилизирующий препарат, который столь же эффективен, а при достаточно высокой дозировке более эффективен, чем 8-метоксипсорален, в лечении псориазных поражений[8]. Было показано, что он является ценной альтернативой 8-метоксипсоралену из-за относительного отсутствия побочных эффектов во время лечения, таких как эритема, зуд и тошнота[9].
Бергаптен также считается потенциальным средством профилактики рака кожи, вызванного солнечным светом. Специальное исследование выявило, что загар, полученный с помощью бергаптена, вызывал меньше повреждений ДНК у людей[10]. Было показано, что бергаптен обладает противоопухолевым действием, например, благодаря его способности вызывать аутофагический процесс в клетках рака груди. Одно исследование показало, что это стало возможным благодаря усилению экспрессии гена PTEN в этих клетках рака груди[11].
Бергаптен, наряду с другими фуранокумаринами, также участвует в ингибировании цитохрома P450[12].
Синтез
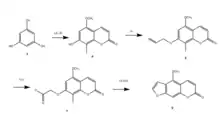
Бергаптен — это натуральное соединение, получаемое из таких растений, как инжир обыкновенный, но его также можно синтезировать. Большинство синтезов линейных фуранокумаринов начинается с центрального ароматического кольца с дальнейшим добавлением двух гетероциклических колец. Желательны альтернативные пути синтеза, чтобы избежать региохимических проблем и умеренных выходов. Описанный здесь синтез включает йод в качестве удаляемой группы для обеспечения региохимической целостности и конвергенции[13]. Как показано на схеме, исходным соединением был флороглюцин (соединение 1). Монометилирование проводили с последующей реакцией с этилпропиолатом в присутствии ZnCl2 с получением 7-гидрокси-5-метоксикумарина (продукт 3, не показан) с выходом 68 %. Затем положение 8 7-гидрокси-5-метоксикумарина защищали йодом, чтобы избежать образования углового фуранокумарина. Продукт 4 на диаграмме — результат этой защиты йодом. Продукт 5 был результатом аллилирования продукта 4. Тетраоксид осмия и метрапериодат натрия использовали для окислительного расщепления O-аллильного производного на альдегидном продукте 7 через промежуточный диол (продукт 6, не показан). Циклизация альдегидного продукта 7 с помощью BF 3 -Et 2 O в тетра- н — бутиламмонийбромид затем было проведено с целью построить фурановое кольцо. Последним шагом было удаление защитной группы йода с помощью Pd(OAc)2 с получением в конечном итоге бергаптена (продукт 9) с выходом 90 %. Синтетический бергаптен был выделен в виде бесцветного соединения со свойствами, спектроскопически идентичными натуральному продукту.
Известное применение бергаптена — синтез фраксинола[14]. Ключевой реакцией в этом синтезе является окисление фуранового кольца виснагина и бергаптена хромовой кислотой.
Примечания
Комментарии
- Называются линейными, поскольку обладают линейной химической структурой.
Источники
- Nielsen, B. E. Coumarins of Umbelliferous plants. — Copenhagen : Royal Danish School of Pharmacy, 1970.
- Mitchell, John. Botanical Dermatology: Plants and Plant Products Injurious to the Skin. — Vancouver : Greengrass, 1979.
- Dugrand-Judek, Audray (November 2015). “The Distribution of Coumarins and Furanocoumarins in Citrus Species Closely Matches Citrus Phylogeny and Reflects the Organization of Biosynthetic Pathways”. PLOS ONE. 10 (11). DOI:10.1371/journal.pone.0142757. PMID 26558757.
- Scott, B. R. (1976). “Molecular and genetic basis of furocoumarin reactions”. Mutat Res. 39 (1): 29—74. DOI:10.1016/0165-1110(76)90012-9. PMID 13299.
- McGovern. Botanical Dermatology. The Electronic Textbook of Dermatology. Internet Dermatology Society (2000). Дата обращения: 29 ноября 2018.
- Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Humans. Geneva: World Health Organization, International Agency for Research on Cancer, 1972-PRESENT (1987). Дата обращения: 4 января 2019.
- Side effects of earl grey tea.
- Honigsmann (Oct 1979). “5-Methoxypsoralen (Bergapten) in photochemotherapy of psoriasis”. British Journal of Dermatology. 101.
- Tanew, Adrian (February 1988). “5-Methoxypsoralen (Bergapten) for photochemotherapy: Bioavailability, phototoxicity, and clinical efficacy in psoriasis of a new drug preparation”. Journal of the American Academy of Dermatology. 18.
- Tisserand, Robert. Essential Oil Safety.
- De Amicis, Francesca (2015). “Bergapten drives autophagy through the up-regulation of PTEN expression in breast cancer cells”. Molecular Cancer. 14. DOI:10.1186/s12943-015-0403-4. PMID 26148846.
- Aldred, Elaine. Haschek and Rousseaux's Handbook of Toxicologic Pathology (Third Edition). — Churchill livingstone, 2009.
- Oda, Kazuaki (June 2005). “An Efficient Synthesis of Bergapten”. Heterocycles. 65: 1985—1988. DOI:10.3987/com-05-10451.
- Schönberg, Alexander (1955). “Furo-chromones and -Coumarins. XII. Synthesis of Fraxinol from Bergapten and of Baicalein from Visnagin”. Journal of the American Chemical Society. 77 (20): 5390—5392. DOI:10.1021/ja01625a055. ISSN 0002-7863.
