Бензоиновая конденсация
Бензоиновая конденсация (часто называемая реакцией конденсации, в силу исторических причин) — реакция между двумя ароматическими альдегидами, в частности, бензальдегидом. Реакция катализируется нуклеофилами, такими как анион цианида или N-гетероциклическими карбенами. Продукт реакции представляет собой ароматический ацилоин с бензоином в качестве исходного соединения[1].
История
Ранняя версия этой реакции была разработана в 1832 году Юстусом фон Либихом и Фридрихом Велером в ходе исследований горького миндального масла[2]. Каталитический вариант этой реакции был разработан Николаем Зининым в конце 1830-х годов[3][4], механизм реакции был предложен в 1903 году А. И. Лэпвортом.[5]
Механизм реакции
На первой стадии, цианид анион (образуемый от цианида натрия) вступает с альдегидами в реакцию нуклеофильного присоединения. Перегруппировка интермедиатов приводит к изменению полярности карбонильной группы, которая затем присоединяет вторую карбонильную группу посредством второго нуклеофильного присоединения. В результате переноса протона и элиминирования цианид иона образуется бензоин. Эта реакция обратима.
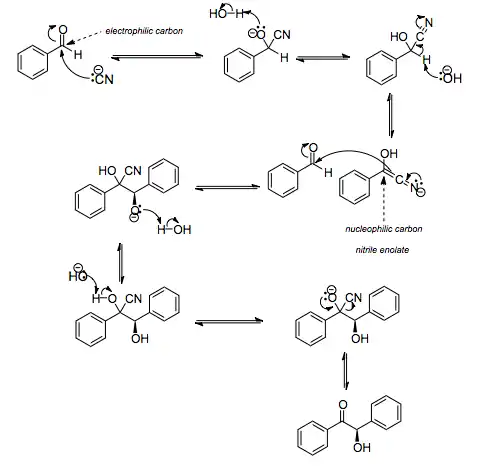
Цианид иона служит трем различным целям в этой реакции. Он действует как нуклеофил, облегчает отщепление протона, а также уходящей группы на заключительном этапе. В бензоиновая конденсация является скорее димеризацией, а не конденсацией потому, что малые молекулы, такие как вода, не выделяется в процессе этой реакции. По этой причине реакция называется также бензоиновое присоединение. В этой реакции два альдегида служат разным целям; один альдегид служит донором протона, а второй акцептором. Таким образом можно синтезировать смешанные бензоины, то есть продукты с различными группами на каждой стороне молекулы.
Область применения
Реакция может быть использована для алифатических альдегидов с основными катализаторами в присутствии солей тиазола; механизм реакции по сути тот же. Также эти соединения имеют важное значение в синтезе гетероциклических соединений. В дополнение данная реакция возможна с енонами, например с метилвинилкетоном в качестве реагента для реакции Штеттера.
В биохимии, кофермент тиамина отвечает за биосинтез ацилоин-подобных соединений. Этот кофермент также содержит долю тиазола, который при депротонировании становится нуклеофильным карбеном.
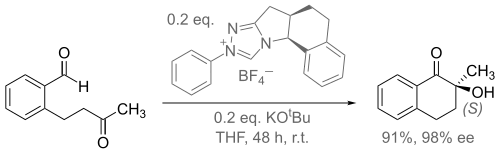
В одном исследовании, специально разработанный N-гетероциклический карбен (NHC основание, связанное с солью тиазола) был использован, для облегчения энантиоселективной внутримолекулярной конденсации бензоина (схема 2)[6].
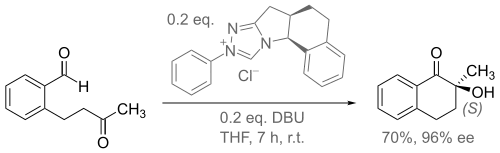
Этот вывод был подтвержден в другом исследовании с немного изменённой NHC используя ДБУ в качестве основания вместо трет-бутоксида калия (схема 3)[6].
См. также
Примечания
- Roger Adams and C. S. Marvel (1941), Benzoin, Org. Synth., <http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv1p0094>; Coll. Vol. Т. 1: 94
- Wöhler, Liebig; Wöhler, Liebig. Untersuchungen über das Radikal der Benzoesäure (нем.) // Annalen der Pharmacie : magazin. — 1832. — Bd. 3, Nr. 3. — S. 249—282. — doi:10.1002/jlac.18320030302.
- N. Zinin; N. Zinin. Beiträge zur Kenntniss einiger Verbindungen aus der Benzoylreihe (нем.) // Annalen der Pharmacie : magazin. — 1839. — Bd. 31, Nr. 3. — S. 329—332. — doi:10.1002/jlac.18390310312.
- N. Zinin; N. Zinin. Ueber einige Zersetzungsprodukte des Bittermandelöls (нем.) // Annalen der Pharmacie : magazin. — 1840. — Bd. 34, Nr. 2. — S. 186—192. — doi:10.1002/jlac.18400340205.
- Lapworth, A. CXXII.—Reactions involving the addition of hydrogen cyanide to carbon compounds. Part II. Cyanohydrins regarded as complex acids (англ.) // Journal of the Chemical Society : journal. — Chemical Society, 1904. — Vol. 85. — P. 1206—1214. — doi:10.1039/CT9048501206.
- Hiroshi Takikawa, Yoshifumi Hachisu, Jeffrey W. Bode, Keisuke Suzuki. Catalytic Enantioselective Crossed Aldehyde–Ketone Benzoin Cyclization (англ.) // Angewandte Chemie International Edition. — 2006-05-19. — Vol. 45, iss. 21. — P. 3492—3494. — ISSN 1521-3773. — doi:10.1002/anie.200600268.