Бензоилпероксид
Бензоилпероксид (дибензоилпероксид, пероксид бензоила) — органическое соединение ароматического ряда, относящееся к диацилпероксидам и содержащее пероксидную группу O−O, связанную с двумя бензоильными группами C6H5−C(O)−.
| Бензоилпероксид | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Бензоилпероксид |
| Традиционные названия | перекись бензоила |
| Хим. формула | (C6H5CO2)2 |
| Рац. формула | C14H10O4 |
| Физические свойства | |
| Молярная масса | 242,23 г/моль |
| Плотность | 1,334 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 106—108 °C |
| • вспышки | 176 ± 1 ℉[1] |
| • самовоспламенения | 80 ± 1 °C[2] |
| Давление пара | 1 ± 1 мм рт.ст.[1] |
| Классификация | |
| Рег. номер CAS | 94-36-0 |
| PubChem | 7187 |
| Рег. номер EINECS | 202-327-6 |
| SMILES | |
| InChI | |
| RTECS | DM8575000 |
| ChEBI | 82405 |
| Номер ООН | 3104 |
| ChemSpider | 6919 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Физические и химические свойства
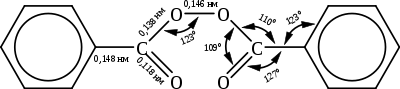
Бензоилпероксид представляет собой бесцветные кристаллы с орторомбической решёткой (a = 0,891 нм; b = 1,424 нм; c = 0,940 нм; Z = 4; пространственная группа P212121). Молекула бензоилпероксида имеет следующее строение:
Растворяется в простых и сложных эфирах, хуже растворяется в керосине и петролейном эфире, не растворяется в диэтиленгликоле и кремнийорганических жидкостях. Умеренно растворяется в ацетоне (15,7 %), метилэтилкетоне (16,0 %), бензоле (15,8 %), стироле (12,5 %), метилметакрилате (12,7 %).
Пероксид бензоила подвергается термическому распаду с образованием радикалов по следующей реакции:
Образующиеся радикалы способны вызывать индуцированный распад исходного вещества. Распад ускоряется в присутствии ионов переходных металлов.
Чистый пероксид бензоила способен быстро воспламеняться и гореть с большой интенсивностью; горение его больших количеств переходит во взрыв. Он также взрывается при нагревании, ударе и трении. Однако смесь бензоилпероксида с водой с содержанием последней выше 20 % устойчива. Органические вещества способны воспламеняться при соприкосновении с бензоилпероксидом. Бензоилпероксид воспламеняется при действии минеральных кислот.
Водные растворы бензоилпероксида гидролизуются до пербензойной и бензойной кислот:
Выступает окислителем: окисляет замещённые фосфины R3P до R3PO, сульфиды до сульфоксидов. При взаимодействии с азотной кислотой вступает в реакции замещения в бензольное ядро в мета-положение.
Получение и применение
Синтез бензоилпероксида заключается в реакции бензоилхлорида с пероксидом водорода в щелочном растворе. Его содержание определяют методом иодометрического титрования в среде ацетона на холоду.
Пероксид бензоила используется:
- как инициатор радикальной полимеризации;
- в органической химии как источник фенильных радикалов, отвердитель полиэфирных смол, в качестве вулканизирующего агента;
- в кино для изображения взрывов больших объёмов горючесмазочных материалов (бочки, цистерны), так как является более дешёвым[прояснить];
- для лечения акне;
- в пищевой промышленности под индексом Е928, например, для отбеливания муки.
Примечания
Литература
- Кнунянц И. Л. и др. Химическая энциклопедия. — М.: Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — 623 с. — 100 000 экз.