Диацилпероксиды
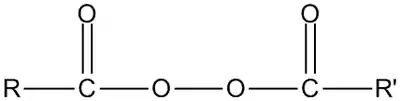
Диацилпероксиды — органические пероксидные соединения, содержащие ацильные группы, соединённые пероксидной связью O-O, с общей формулой RC(O)OOC(O)R'.
Номенклатура
Диацилпероксиды могут быть как симметричными RC(O)OOC(O)R, так и несимметричными RC(O)OOC(O)R'. Их название образуется из названий соответствующих ацильных групп и окончания «пероксид»:
- — диацетилпероксид
- — ацетилпропионилпероксид
Получение
Диацилпероксиды получают следующими способами:
- Ацилирование пероксида водорода
Проводят соответствующими ангидридами и хлорангидридами органических кислот, получая симметричные диацилпероксиды:
- Ацилирование перкислот и их солей
Данный способ позволяет получить несимметричные диацилпероксиды. Ацилирование хлорангидридами кислот проводят в присутствии оснований, например, в среде пиридина:
Физические и химические свойства
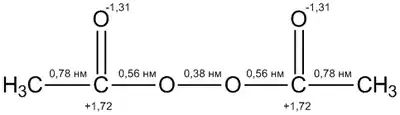
Молекулы диацилпероксидов являются полярными, в частности, для диацетилпероксида дипольный момент равен 1,58 Д. Молекулы являются неплоскими — диэдральный угол C-O-O-C составляет около 100°
Низшие диацилпероксиды являются нестабильными соединениями и способны взрываться при нагревании и механическом воздействии. Их растворы гораздо устойчивее.
Термолиз диацилпероксидов протекает с разрывом пероксидной связи O-O с образованием двух ацильных радикалов, которые быстро декарбоксилируются:
Образовавшиеся радикалы вступают в реакции с молекулами растворителя, образуя различные продукты присоединения, димеризации и др.
Диацилпероксиды реагируют с нуклеофильными реагентами, в частности, с аминами, енаминами, основаниями Шиффа.
Диацилпероксиды проявляют окислительные свойства: органические сульфиды превращают в сульфоксиды и сульфоны, фосфиты — в оксиды фосфитов и др.
Литература
- В. Л. Антоновский, С. Л. Хурсан. Физическая химия органических пероксидов. — М.: ИКЦ «Академкнига», 2003. — 391 с. — 400 экз. — ISBN 5-94628-126-7.
- А. И. Рахимов. Химия и технология органических перекисных соединений. — М.: «Химия», 1979. — 392 с. — 2900 экз.
- Э. Дж. Э. Хавкинс. Органические перекиси, их получение и реакции. — М., Ленинград: «Химия», 1961. — 536 с. — 4000 экз.
- В. Карножицкий. Органические перекиси. — М.: Издательство иностранной литературы, 1961. — 155 с.