Ацетат цинка
Ацета́т ци́нка — химическое соединение, соль цинка и уксуснокислая.
| Ацетат цинка | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Ацетат цинка |
| Традиционные названия | Цинк уксуснокислый |
| Хим. формула | C4H6O4Zn |
| Рац. формула | (CH3COO)2Zn |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса |
219,50 (дигидрат) 183,48 (ангидрат) г/моль |
| Плотность | 1,735 г/см³ (дигидрат) |
| Термические свойства | |
| Температура | |
| • плавления | 237 °C (дигидрат при 100 °C) |
| Химические свойства | |
| Растворимость | |
| • в воде | 43 г/100 мл (20 °C, дигидрат) |
| Структура | |
| Гибридизация | тетраэдр |
| Координационная геометрия | октаэдр (дигидрат) |
| Классификация | |
| Рег. номер CAS | 557-34-6 |
| PubChem | 11192 |
| Рег. номер EINECS | 209-170-2 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E650 |
| RTECS | ZG8750000 |
| ChEBI | 62984 |
| Номер ООН | H2ZEY72PME |
| ChemSpider | 10719 |
| Безопасность | |
| Фразы риска (R) | R22 R36 R50/53 |
| Фразы безопасности (S) | S26 S60 S61 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Свойства
При нормальных условиях ацетат цинка представляет собой бесцветные кристаллы, растворимые в воде и многих органических растворителях (например, в метаноле, ацетоне, анилине, пиридине). Образует кристаллогидраты, также существует в виде безводных форм.
Может быть получено путём растворения например, карбоната цинка в уксусной кислоте. При этом реакция происходит эффективнее при взаимодействии с разбавленными растворами уксусной кислоты и при нагревании.
Базовые свойства
Ацетатная группа способна связываться с ионами металлов различными способами, через связи с её двумя атомами кислорода.
Известно несколько соединений с иными металлами для различных гидратов ацетата цинка.
Лишённый кристаллизационной воды, ацетат цинка приобретает полимерную структуру, состоящую из цинка, соединённого с четырьмя атомами кислорода пространственно в виде тетраэдров, каждый тетраэдр соединён с соседними посредством ацетатных групп[1].
Лиганды ацетата цинка не бидентантны. В отличие от этого соединения, большинство металлических диацетатов связывают атомы иных металлов в октаэдральном координационном расположении с бидентатными ацетатными группами. В дигидрате ацетата цинка цинк октаэдрален, тогда как обе ацетатные группы бидентантны[2].
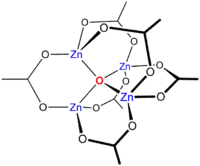
Основной ацетат цинка
Нагрев Zn(CH3CO2)2 в вакууме даёт потерю уксусного ангидрида, оставляя осадок основного ацетата цинка с формулой Zn4O(CH3CO2)6. Этот кластер имеет тетраэдрическую структуру.
Молекула соединения напоминает соответствующую ацетатную бериллиевую соль, но с немного увеличенными межатомными расстояниями, длина связи Zn-O ~1.97 Å, против ~1.63 Å для Be4O(OAc)6[3].
Применение
Пищевое и медицинское применение
Ацетат цинка используется в лечении назофарингита. Мета-анализ показал, что 3 повышенные дозы препарата снижают на 42 % длительность назофарингита[4].
Ацетат цинка особенно показан в виде примеси в пастилках[5][6].
Хотя пастилки с ацетатом цинка укорачивают длительность назофарингита, многие цинковые пастилки на рынке США, к сожалению, имеют либо слишком низкое содержание цинка, либо ингредиенты, связывающие ионы цинка, например лимонную кислоту[7]. Так что, выигрыш от высоких доз в активного цинка в тестовом изучении может и не проявляться в обыденном применении потребителями.
Ацетат цинка может быть использован для лечения недостатка цинка. Он может быть использован для ингибирования усвоения меди при Болезни Вильсона — Коновалова. Ацетат цинка также используется в качестве вяжущего средства в мазях, лосьонах; или, в смеси с антибиотиком, например эритромицином для лечения акне.
Также известны другие медицинские применения ацетата цинка: мазь против зуда, противогрибковое средство, компонент зубных цементов.
В жевательной резинке ацетат цинка — освежитель дыхания[8][9] и ингибитор налёта.[10].
Ацетат цинка входит в список разрешенных к применению пищевых добавок как пищевая добавка E650.
Промышленное применение
В промышленности ацетат цинка применяется как протрава для придания грибковой устойчивости древесине. Производство других солей цинка, полимеров, производство этилацетата, этилена, протравы при окрашивании тканей, катализатора в органическом синтезе и аналитического реактива.
Используется на атомных электростанциях в качестве поверхностного ингибитора в водяных трубопроводах первого контура.
Ацетат цинка используется для получения в золь-гель процессе слоев прозрачного полупроводника — оксида цинка.
Примечания
- Capilla, A. V.; Aranda, R. A. Anhydrous Zinc(II) Acetate (CH3-COO)2Zn (рум.) // Crystal Structure Communications. — 1979. — Т. 8. — P. 795—797.
- J. N. van Niekerk, F. R. L. Schoening and J. H. Talbot. The crystal structure of zinc acetate dihydrate, Zn(CH3COO)2·2H2O (неопр.) // Acta Cryst.. — 1953. — Т. 6, № 8. — С. 720—723. — doi:10.1107/S0365110X53002015.
- Koyama, H.; Saito, Y. The Crystal Structure of Zinc Oxyacetate, Zn4O(CH3COO)6 (англ.) // Bull. Chem. Soc. Japan : journal. — 1954. — Vol. 27, no. 2. — P. 112—114. — doi:10.1246/bcsj.27.112.
- Hemilä H (2011) Zinc lozenges may shorten the duration of colds: a systematic review. Open Respir Med J 5:51-8 Refs with links: http://www.mv.helsinki.fi/home/hemila/Zn/TORMJ.htm
- Eby GA (2004) Zinc lozenges: cold cure or candy? Solution chemistry determinations. Biosci Rep 24:23-39 Архивировано 29 октября 2013 года.
- Eby GA (2010) Zinc lozenges as cure for the common cold. Med Hypotheses 74:482-92
- Eby G (2009) Zinc Lozenges as a Common Cold Treatment
- Espacenet — Bibliographic data
- Espacenet — Bibliographic data
- Giertsen E., Svatun B., Saxton A. Plaque inhibition by hexetidine and zinc (неопр.) // Scand J Dent Res. — 1987. — February (т. 95, № 1). — С. 49—54. — PMID 3470899.