Ангиотензинпревращающий фермент 2
Ангиотензинпревращающий фермент 2 (АПФ2, ACE2; КФ:3.4.17.23)[1] — мембранный белок, экзопептидаза, катализирующая превращение ангиотензина I в ангиотензин 1-9[2] и ангиотензина II в ангиотензин 1-7[3][4].
АПФ2 человека является рецептором и точкой входа в клетку некоторых коронавирусов[1][5].
Структура
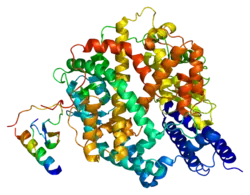
Ангиотензин-превращающий фермент 2 представляет собой цинксодержащий металлофермент. Он состоит из 805 аминокислот, молекулярная масса 92,5 кДа. Содержит 7 участков N-гликозилирования. Секретируемая форма образуется за счёт протеолитического расщепления протеазой ADAM17, а также сериновыми протеазами TMPRSS2, TMPRSS11D и HPN/TMPRSS1[6].
Каталитическая активность
АПФ2 катализирует следующую реакцию:
- ангиотензин II + H2O = ангиотензин (1-7) + L-фенилаланин
Тканевая экспрессия
АПФ2 экспрессируется в большинстве тканей. Главным образом белок находится на мембранах пневмоцитов II типа, энтероцитов тонкого кишечника, эндотелиальных клеток артерий и вен, а также гладкомышечных клеток в большинстве органов. Кроме этого, мРНК для АПФ2 обнаружена в клетках коры головного мозга, полосатого тела, гипоталамуса и ствола головного мозга[7]. Наличие АПФ2 на нейронах головного мозга и глии делает эти клетки чувствительными к инфицированию вирусом SARS-CoV-2, что может приводить к потере обоняния и развитию неврологического дефицита, наблюдаемых при заболевании COVID-19[8]. Потеря обоняния и потеря вкуса наблюдается у многих больных COVID-19 и рассматривается как особенность симптоматики заболевания[9]. Академия отоларингологии США считает эти нарушения важными симптомами COVID-19[10].
Функции
АПФ2 — карбоксипептидаза, конвертирующая ангиотензин I в ангиотензин 1-9, нонапептид с неизвестной функцией, и ангиотензин II в ангиотензин 1-7, обладающий вазодилаторной активностью[2][11][12]. С высокой эффективностью может гидролизовать апелин-13 и динорфин-13[12]. За счёт конвертации ангиотензина II может играть важную роль в сердечной функции[2][11]. Участвует в транспорте аминокислот, взаимодействуя с транспортёром SL6A19 в кишечнике и регулируя его перенос, экспрессию на поверхности клеток и его каталитическую активность[13][14].
В патологии
Обнаружено, что АПФ2 имеет сродство к S-гликопротеинам некоторых коронавирусов, включая вирусы SARS-CoV[15] и SARS-CoV-2[16][17][18], и является, таким образом, точкой проникновения вируса в клетку. Более того предполагается, что инфекция SARS-CoV-2 может, подавляя АПФ2, приводить к токсическому избыточному накоплению ангиотензина II и брадикинина[19], что вызывает острый респираторный дистресс-синдром, отёк лёгких и миокардит[20][21].
Механизм течения COVID-19
Группа учёных при изучении механизмов течения коронавирусного заболевания обратила внимание на работу гормональной системы регулирования кровяного давления (РААС). Поскольку коронавирус прикрепляется к ангиотензин-рецептору на поверхности клетки и увеличивает синтез АПФ2, попадая с помощью этой молекулы в клетку, это вызывает значительное увеличение концентрации брадикинина (брадикининовый шторм) и критические осложнения, особенно у пациентов с гипертонией, принимающих препараты с брадикинином для регулирования кровяного давления[22]:
- неадекватное расширение сосудов = слабость, утомляемость, нарушения ритма сердца;
- увеличение проницаемости сосудов, что приводит к росту миграции иммунных клеток и усилению воспаления, а также риску отёков[23];
- усиление синтеза гиалуроновой кислоты (в том числе, в легких), которая вместе с тканевой жидкостью образует гидрогель в просвете альвеол, вызывая проблемы с дыханием и обусловливая неэффективность ИВЛ;
- потенциальное увеличение концентрации тканевого активатора плазминогена, с ростом риска кровотечений;
- потенциальное повышение проницаемости гематоэнцефалического барьера, вызывающее неврологическую симптоматику.
В исследовании отмечается, что побочными эффектами ИАПФ являются потеря обоняния, сухой кашель и утомляемость, отмечаемые при коронавирусной инфекции[22].
Академик В.В. Зверев с коллегами (П.О. Шатунова, А.С. Быков, О.А. Свитич), проанализировав межмолекулярные взаимодействия, установили что SARS-CoV-2 более вирулентен вследствие снижения свободной энергии при связывании с АПФ2 (АСЕ2), транспортирующим вирус в клетку-хозяина. Детальное изучение этого фермента, который является рецептором на поверхности различных тканей организма человека и в норме отвечает за превращение ангиотензина II в ангиотензин (1–7), привело учёных к выводу о том, что перспективным терапевтическим направлением при коронавирусной инфекции может оказаться влияние на ренин-ангиотензиновую систему. Дело в том, что рецептор АПФ2 — нетканеспецифичный: он широко распространен в сердце, почках, тонкой кишке, яичках, щитовидной железе, жировой ткани. Он не только регулирует давление, но также подавляет воспаление, преимущественно в лёгочной ткани, участвует в транспорте аминокислот и поддерживает жизнедеятельность микробиома кишечника. Учёные получили предварительные данные об эффективности применения ингибиторов и блокаторов АПФ2 для лечения пациентов с коронавирусной инфекцией[24].
Учёные подчёркивают, что смертность от COVID-19 повышается в группах пожилых людей (старше 70 лет) и лиц с хроническими заболеваниями (гипертензией, сахарным диабетом, сердечно-сосудистыми нарушениями), принимающих лекарства, ингибирующие рецепторы АПФ. Поскольку АПФ2, расположенный на альвеолярных эпителиальных клетках, служит котранспортером для SARS-CoV-2 в клетки лёгких человека, изучение этого рецептора является ключом для понимания механизма развития COVID-19[24].
АПФ, вакцины и лечение ковида
Академик В.В. Зверев, разъясняя механизм действия вакцин от коронавируса и говоря, что они, по идее, должны помогать от всех штаммов, обратил внимание на риск блокирования АПФ2 в результате образования стимулированных вакциной антител на тот участок вируса, который связывается с рецептором АПФ2, поскольку эти же антитела могут взаимодействовать и с этим самым человеческим белком. «А этот рецептор вовсе не для вируса. Он существует для очень важного фермента клеточного, который участвует в нормализации давления», — подчеркнул академик. Он также отметил, что у детей рецепторов АПФ2 очень мало, поэтому они практически не болеют и их вообще не надо вакцинировать: «Таких детей, которые умирают, вообще нельзя вакцинировать ничем и ни от чего. Это дети с тяжелой „хроникой“, с нарушенным здоровьем. Таких детей надо беречь и лечить правильно»[25].
Группа учёных под руководством академика Зверева изучала роль АПФ2 в ряде патологических и физиологических состояний и установила, что дефицит этого белка способен вызвать тяжелые заболевания органов дыхания и острые патологические респираторные состояния, причём не только при коронавирусной инфекции. Наличие AПФ2 в яичках и тестикулярных сосудах объясняет большую восприимчивость мужчин к COVID-19. Рост риска смертности для мужчин по сравнению с женщинами и для пожилых людей относительно молодых связан с возрастными и функциональными особенностями механизмов врожденного и адаптивного иммунитета и способностью SARS-CoV-2 вызывать цитокиновый шторм и иммунопатологические нарушения у пациентов с коронавирусной инфекцией[24].
Напротив, у лабораторных мышей при массивном отёке легких, гипоксии, гиалинозе и воспалительных клеточных инфильтратов, при введении рекомбинантного АПФ2 лёгочная ткань восстанавливалась. АПФ2 также положительно влияет на нереспираторные органы: повышает сократительную способность сердца, предотвращает почечные воспаления, участвует во всасывании аминокислот через тонкий кишечник, регулируя секрецию антимикробных пептидов, влияющих на состав кишечного микробиома. Концентрация AПФ2 может увеличиваться после ишемического инсульта, что является компенсаторной реакцией по устранению избытка Ang1-7[24].
Рекомбинантный АПФ2
Создан человеческий рекомбинантный растворимый ангиотензинпревращающий фермент 2 (hrsACE2), который под названием APN01 уже проходит вторую фазу клинических испытаний на способность лечить от пневмонии, вызванной коронавирусом SARS-CoV-2. Предполагается что APN01, имитируя человеческий АПФ2, позволяет двояко противодействовать болезни. Во-первых, вирус связывается с растворимым АПФ2 / APN01 вместо АПФ2 на клеточной поверхности, что означает, что вирус больше не может заразить клетки. Во-вторых, APN01, действуя как АПФ2, уменьшает вредные воспалительные реакции в лёгких и других органах и защищает их от повреждения[26][27]
Примечания
- Gene: ACE2, angiotensin I converting enzyme 2. National Center for Biotechnology Information (NCBI). U.S. National Library of Medicine (28 февраля 2020).
- Donoghue M., Hsieh F., Baronas E., Godbout K., Gosselin M., Stagliano N et al. A novel angiotensin-converting enzyme-related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1-9 (англ.) // Circ Res : journal. — 2000. — Vol. 87, no. 5. — P. E1—9. — doi:10.1161/01.res.87.5.e1. — PMID 10969042.
- Keidar S., Kaplan M., Gamliel-Lazarovich A. ACE2 of the heart: From angiotensin I to angiotensin (1-7) (англ.) // Cardiovascular Research : journal. — 2007. — February (vol. 73, no. 3). — P. 463—469. — doi:10.1016/j.cardiores.2006.09.006. — PMID 17049503.
- Wang W., McKinnie S. M., Farhan M., Paul M., McDonald T., McLean B., Llorens-Cortes C., Hazra S., Murray A. G., Vederas J. C., Oudit G. Y. Angiotensin Converting Enzyme 2 Metabolizes and Partially Inactivates Pyrapelin-13 and Apelin-17: Physiological Effects in the Cardiovascular System (англ.) // Hypertension : journal. — 2016. — May (vol. 68). — P. 365—377. — doi:10.1161/HYPERTENSIONAHA.115.06892. — PMID 27217402.
- Kasmi Y., Khataby K., Souiri A. Coronaviridae: 100,000 Years of Emergence and Reemergence // Emerging and Reemerging Viral Pathogens / Ennaji M. M.. — Elsevier, 2019. — Т. Volume 1: Fundamental and Basic Virology Aspects of Human, Animal and Plant Pathogens. — С. 135. — ISBN 978-0-12-819400-3.
- Lambert D. W., Yarski M., Warner F. J., Thornhill P., Parkin E. T., Smith AI et al. Tumor necrosis factor-alpha convertase (ADAM17) mediates regulated ectodomain shedding of the severe-acute respiratory syndrome-coronavirus (SARS-CoV) receptor, angiotensin-converting enzyme-2 (ACE2) (англ.) // J Biol Chem : journal. — 2005. — Vol. 280, no. 34. — P. 30113—30119. — doi:10.1074/jbc.M505111200. — PMID 15983030.
- Kabbani, Nadine; Olds, James L. Does COVID19 infect the brain? If so, smokers might be at a higher risk (англ.) // Molecular Pharmacology : journal. — 2020. — 1 April (vol. 97, no. 5). — P. 351—353. — doi:10.1124/molpharm.120.000014. — PMID 32238438.
- Baig AM. Neurological manifestations in COVID-19 caused by SARS-CoV-2. CNS Neurosci Ther. 2020;26(5):499-501. doi:10.1111/cns.13372
- Baig AM, Khaleeq A, Ali U, Syeda H. Evidence of the COVID-19 Virus Targeting the CNS: Tissue Distribution, Host-Virus Interaction, and Proposed Neurotropic Mechanisms. ACS Chem Neurosci. 2020;11(7):995-998. doi:10.1021/acschemneuro.0c00122
- Coronavirus Disease 2019: Resources | American Academy of Otolaryngology-Head and Neck Surgery (недоступная ссылка). Entnet.org. Дата обращения: 4 мая 2020. Архивировано 24 марта 2020 года.
- Tipnis S. R., Hooper N. M., Hyde R., Karran E., Christie G., Turner A. J. A human homolog of angiotensin-converting enzyme. Cloning and functional expression as a captopril-insensitive carboxypeptidase (англ.) // J Biol Chem : journal. — 2000. — Vol. 275, no. 43. — P. 33238—33243. — doi:10.1074/jbc.M002615200. — PMID 10924499.
- Vickers C., Hales P., Kaushik V., Dick L., Gavin J., Tang J et al. Hydrolysis of biological peptides by human angiotensin-converting enzyme-related carboxypeptidase (англ.) // J Biol Chem : journal. — 2002. — Vol. 277, no. 17. — P. 14838—14843. — doi:10.1074/jbc.M200581200. — PMID 11815627.
- Kowalczuk S., Bröer A., Tietze N., Vanslambrouck J. M., Rasko J. E., Bröer S. A protein complex in the brush-border membrane explains a Hartnup disorder allele (англ.) // The FASEB Journal : journal. — Federation of American Societies for Experimental Biology, 2008. — Vol. 22, no. 8. — P. 2880—2887. — doi:10.1096/fj.08-107300. — PMID 18424768.
- Camargo S. M., Singer D., Makrides V., Huggel K., Pos K. M., Wagner CA et al. Tissue-specific amino acid transporter partners ACE2 and collectrin differentially interact with hartnup mutations (англ.) // Gastroenterology : journal. — 2009. — Vol. 136, no. 3. — P. 872—882. — doi:10.1053/j.gastro.2008.10.055. — PMID 19185582.
- Kuba K., Imai Y., Rao S., Gao H., Guo F., Guan B., Huan Y., Yang P., Zhang Y., Deng W., Bao L., Zhang B., Liu G., Wang Z., Chappell M., Liu Y., Zheng D., Leibbrandt A., Wada T., Slutsky A. S., Liu D., Qin C., Jiang C., Penninger J. M. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury (англ.) // Nature Medicine : journal. — 2005. — August (vol. 11, no. 8). — P. 875—879. — doi:10.1038/nm1267. — PMID 16007097.
- Letko, Michael; Munster, Vincent. Functional assessment of cell entry and receptor usage for lineage B β-coronaviruses, including 2019-nCoV (англ.) // bioRxiv : journal. — 2020. — 22 January. — P. 2020.01.22.915660. — doi:10.1101/2020.01.22.915660.
- Gralinski, Lisa E.; Menachery, Vineet D. Return of the Coronavirus: 2019-nCoV // Viruses. — 2020. — Т. 12, № 2. — С. 135. — doi:10.3390/v12020135.
- Ou X., Liu Y., Lei X., Li P., Mi D., Ren L. et al. Characterization of spike glycoprotein of SARS-CoV-2 on virus entry and its immune cross-reactivity with SARS-CoV (англ.) // Nature Communications : journal. — Nature Publishing Group, 2020. — Vol. 11, no. 1. — P. 1620. — doi:10.1038/s41467-020-15562-9. — PMID 32221306.
- van de Veerdonk, F.; Netea, M.G.; van Deuren, M.; van der Meer, J.W.; de Mast, Q.; Bruggemann, R.J.; van der Hoeven, H. Kinins and Cytokines in COVID-19: A Comprehensive Pathophysiological Approach. Preprints 2020, 2020040023 (doi: 10.20944/preprints202004.0023.v1). (англ.)
- Hanff, T. C., Harhay, M. O., Brown, T. S., Cohen, J. B., & Mohareb, A. M. (2020). Is There an Association Between COVID-19 Mortality and the Renin-Angiotensin System—a Call for Epidemiologic Investigations. Clinical Infectious Diseases. PMID 32215613 doi:10.1093/cid/ciaa329
- Cheng, H., Wang, Y., & Wang, G. Q. (2020). Organ‐protective Effect of Angiotensin‐converting Enzyme 2 and its Effect on the Prognosis of COVID‐19. Journal of Medical Virology. PMID 32221983 doi:10.1002/jmv.25785
- Шахматова, О.О. Брадикининовый шторм: новые аспекты в патогенезе COVID-19. cardioweb.ru. НАЦИОНАЛЬНЫЙ МЕДИЦИНСКИЙ ИССЛЕДОВАТЕЛЬСКИЙ ЦЕНТР КАРДИОЛОГИИ Министерства здравоохранения РФ. Дата обращения: 23 ноября 2020.
- Huamin Henry Li. Angioedema: Practice Essentials, Background, Pathophysiology (англ.) // MedScape. — 2018-09-04.
- Полина Олеговна Шатунова, Анатолий Сергеевич Быков, Оксана Анатольевна Свитич, Виталий Васильевич Зверев. Ангиотензинпревращающий фермент 2. Подходы к патогенетической терапии COVID-19 // Журнал микробиологии, эпидемиологии и иммунобиологии. — 2020-09-02. — Т. 97, вып. 4. — С. 339–345. — ISSN 2686-7613. — doi:10.36233/0372-9311-2020-97-4-6.
- Руслан Давлетшин. «Говорят, что все привитые умрут»: академик РАН Зверев — о вакцинах, клеточной памяти и мутациях. Вечерняя Москва (9 ноября 2021). Дата обращения: 22 декабря 2021.
- Phase 2 Clinical Trial of APN01 for Treatment of COVID-19 Inititated
- APN01 treatment of COVID-19
Литература
- Turner A. J., Tipnis S. R., Guy J. L., Rice G., Hooper N. M. ACEH/ACE2 is a novel mammalian metallocarboxypeptidase and a homologue of angiotensin-converting enzyme insensitive to ACE inhibitors (англ.) // Canadian Journal of Physiology and Pharmacology : journal. — 2002. — April (vol. 80, no. 4). — P. 346—353. — doi:10.1139/y02-021. — PMID 12025971.
- Turner A. J., Hiscox J. A., Hooper N. M. ACE2: from vasopeptidase to SARS virus receptor (англ.) // Trends in Pharmacological Sciences : journal. — Cell Press, 2004. — June (vol. 25, no. 6). — P. 291—294. — doi:10.1016/j.tips.2004.04.001. — PMID 15165741.
- Katovich M. J., Grobe J. L., Huentelman M., Raizada M. K. Angiotensin-converting enzyme 2 as a novel target for gene therapy for hypertension (англ.) // Experimental Physiology : journal. — 2005. — May (vol. 90, no. 3). — P. 299—305. — doi:10.1113/expphysiol.2004.028522. — PMID 15640278.
- Ferrario C. M., Trask A. J., Jessup J. A. Advances in biochemical and functional roles of angiotensin-converting enzyme 2 and angiotensin-(1-7) in regulation of cardiovascular function (англ.) // American Physiological Society : journal. — 2005. — December (vol. 289, no. 6). — P. H2281—90. — doi:10.1152/ajpheart.00618.2005. — PMID 16055515.
- Jia H. P., Look D. C., Hickey M., Shi L., Pewe L., Netland J., Farzan M., Wohlford-Lenane C., Perlman S., McCray P. B. Infection of human airway epithelia by SARS coronavirus is associated with ACE2 expression and localization (англ.) // Advances in Experimental Medicine and Biology : journal. — Springer Nature, 2006. — Vol. 581. — P. 479—84. — ISBN 978-0-387-26202-4. — doi:10.1007/978-0-387-33012-9_85. — PMID 17037581.
- Lazartigues E., Feng Y., Lavoie J. L. The two fACEs of the tissue renin–angiotensin systems: implication in cardiovascular diseases (англ.) // Current Pharmaceutical Design : journal. — 2007. — Vol. 13, no. 12. — P. 1231—1245. — doi:10.2174/138161207780618911. — PMID 17504232.
- Raizada M. K., Ferreira A. J. ACE2: a new target for cardiovascular disease therapeutics (англ.) // Journal of Cardiovascular Pharmacology : journal. — 2007. — August (vol. 50, no. 2). — P. 112—119. — doi:10.1097/FJC.0b013e3180986219. — PMID 17703127.
- Dean R. G., Burrell L. M. ACE2 and diabetic complications (англ.) // Current Pharmaceutical Design : journal. — 2007. — Vol. 13, no. 26. — P. 2730—2735. — doi:10.2174/138161207781662876. — PMID 17897017.
- Tipnis S. R., Hooper N. M., Hyde R., Karran E., Christie G., Turner A. J. A human homolog of angiotensin-converting enzyme. Cloning and functional expression as a captopril-insensitive carboxypeptidase (англ.) // The Journal of Biological Chemistry : journal. — 2000. — October (vol. 275, no. 43). — P. 33238—33243. — doi:10.1074/jbc.M002615200. — PMID 10924499.
- Donoghue M., Hsieh F., Baronas E., Godbout K., Gosselin M., Stagliano N., Donovan M., Woolf B., Robison K., Jeyaseelan R., Breitbart R. E., Acton S. A novel angiotensin-converting enzyme-related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1-9 (англ.) // Circulation Research : journal. — 2000. — September (vol. 87, no. 5). — P. E1—9. — doi:10.1161/01.res.87.5.e1. — PMID 10969042.
- Vickers C., Hales P., Kaushik V., Dick L., Gavin J., Tang J., Godbout K., Parsons T., Baronas E., Hsieh F., Acton S., Patane M., Nichols A., Tummino P. Hydrolysis of biological peptides by human angiotensin-converting enzyme-related carboxypeptidase (англ.) // The Journal of Biological Chemistry : journal. — 2002. — April (vol. 277, no. 17). — P. 14838—14843. — doi:10.1074/jbc.M200581200. — PMID 11815627.
- Crackower M. A., Sarao R., Oudit G. Y., Yagil C., Kozieradzki I., Scanga S. E., Oliveira-dos-Santos A. J., da Costa J., Zhang L., Pei Y., Scholey J., Ferrario C. M., Manoukian A. S., Chappell M. C., Backx P. H., Yagil Y., Penninger J. M. Angiotensin-converting enzyme 2 is an essential regulator of heart function (англ.) // Nature : journal. — 2002. — June (vol. 417, no. 6891). — P. 822—828. — doi:10.1038/nature00786. — PMID 12075344.
- Harmer D., Gilbert M., Borman R., Clark K. L. Quantitative mRNA expression profiling of ACE 2, a novel homologue of angiotensin converting enzyme (англ.) // FEBS Letters : journal. — 2002. — December (vol. 532, no. 1—2). — P. 107—110. — doi:10.1016/S0014-5793(02)03640-2. — PMID 12459472.
- Donoghue M., Wakimoto H., Maguire C. T., Acton S., Hales P., Stagliano N., Fairchild-Huntress V., Xu J., Lorenz J. N., Kadambi V., Berul C. I., Breitbart R. E. Heart block, ventricular tachycardia, and sudden death in ACE2 transgenic mice with downregulated connexins (англ.) // Journal of Molecular and Cellular Cardiology : journal. — 2003. — September (vol. 35, no. 9). — P. 1043—1053. — doi:10.1016/S0022-2828(03)00177-9. — PMID 12967627.
- Clark H. F., Gurney A. L., Abaya E., Baker K., Baldwin D., Brush J., Chen J., Chow B., Chui C., Crowley C., Currell B., Deuel B., Dowd P., Eaton D., Foster J., Grimaldi C., Gu Q., Hass P. E., Heldens S., Huang A., Kim H. S., Klimowski L., Jin Y., Johnson S., Lee J., Lewis L., Liao D., Mark M., Robbie E., Sanchez C., Schoenfeld J., Seshagiri S., Simmons L., Singh J., Smith V., Stinson J., Vagts A., Vandlen R., Watanabe C., Wieand D., Woods K., Xie M. H., Yansura D., Yi S., Yu G., Yuan J., Zhang M., Zhang Z., Goddard A., Wood W. I., Godowski P., Gray A. The secreted protein discovery initiative (SPDI), a large-scale effort to identify novel human secreted and transmembrane proteins: a bioinformatics assessment (англ.) // Genome Research : journal. — 2003. — October (vol. 13, no. 10). — P. 2265—2270. — doi:10.1101/gr.1293003. — PMID 12975309.
- Li W., Moore M. J., Vasilieva N., Sui J., Wong S. K., Berne M. A., Somasundaran M., Sullivan J. L., Luzuriaga K., Greenough T. C., Choe H., Farzan M. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus (англ.) // Nature : journal. — 2003. — November (vol. 426, no. 6965). — P. 450—454. — doi:10.1038/nature02145. — PMID 14647384.
- Wong S. K., Li W., Moore M. J., Choe H., Farzan M. A 193-amino acid fragment of the SARS coronavirus S protein efficiently binds angiotensin-converting enzyme 2 (англ.) // The Journal of Biological Chemistry : journal. — 2004. — January (vol. 279, no. 5). — P. 3197—3201. — doi:10.1074/jbc.C300520200. — PMID 14670965.
- Towler P., Staker B., Prasad S. G., Menon S., Tang J., Parsons T., Ryan D., Fisher M., Williams D., Dales N. A., Patane M. A., Pantoliano M. W. ACE2 X-ray structures reveal a large hinge-bending motion important for inhibitor binding and catalysis (англ.) // The Journal of Biological Chemistry : journal. — 2004. — April (vol. 279, no. 17). — P. 17996—18007. — doi:10.1074/jbc.M311191200. — PMID 14754895.