Аконитаза
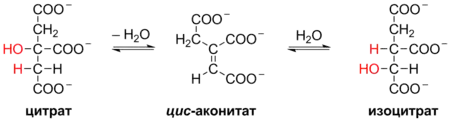
Аконитаза, также аконитатгидратаза (КФ 4.2.1.3) — фермент из класса лиаз, который катализирует стереоспецифическую реакцию изомеризации цитрата в изоцитрат, посредством образования цис-аконитата в цикле Кребса, без окислительно-восстановительного механизма[2][3][4].
| Аконитаза | |
|---|---|
 Структура бычьей аконитазы(PDB 1AMI) | |
| Идентификаторы | |
| Шифр КФ | 4.2.1.3 |
| Номер CAS | 9024-25-3 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9024-25-3 |
| Aconitase family (aconitate hydratase) | |
|---|---|
 Structure of aconitase.[1] | |
| Идентификаторы | |
| Символ | Aconitase |
| Pfam | PF00330 |
| InterPro | IPR001030 |
| PROSITE | PDOC00423 |
| SCOP | 1aco |
| SUPERFAMILY | 1aco |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Аконитаза встречается у всех эукариот и бактерий в цитозоле. Многоклеточные организмы имеют дополнительную митохондриальную форму (так называемая аконитаза-2).
У человека аконитаза-1 кодируется геном ACO1, который локализован на коротком плече (p-плече) 9-ой хромосомы. Ген аконитазы-2 ACO2, локализуется на длинном плече (q-плече) 22-ой хромосомы.
Структура
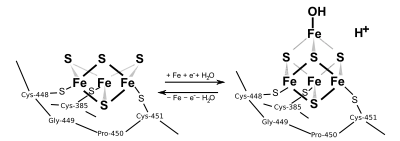
Аконитаза состоит из четырёх доменов, три из которых тесно связаны друг с другом. Четвёртый домен, с тремя другими, образует карман, в котором происходит катализ. Каталитическая активность фермента зависит от специфической конформации, за которую отвечают железосерный кластер [4Fe-4S] и несколько аминокислотных остатков, которые позволяют протекать стереоспецифической реакции переноса молекулы воды с ахирального цитрата исключительно на изоцитрат.
Митохондриальная аконитаза, содержит остатки цистеина в позициях -385, -458 и -451, а также железосерный кластер [4Fe-4S], который имеет решающее значение для её каталитической активности. В неактивном состоянии в кластере отсутствует четвёртый атом железа, который слабо связан и первоначально имеет координационное число 4 (тетраэдрическая структура): три атома серы и один ион гидроксида (воды) в качестве связующего партнёра (см. Рисунок). В каталитической фазе координационное число атома железа увеличивается до 6 (октаэдрическая структура), а затем присоединяется дополнительный изоцитрат и другая молекула воды[5].
Выполняемые функции
В отличие от большинства железосернистых белков, которые функционируют в качестве электронных носителей, железо-серный кластер аконитазы непосредственно взаимодействует с субстратом фермента. Аконитаза имеет активный кластер [Fe4S4]2+, который может превращаться в неактивную форму [Fe3S4]+. Было показано, что три остатка цистеина (Cys) являются лигандами центра [Fe4S4]. В активном состоянии лабильный ион железа кластера [Fe4S4] координируется не Cys, а молекулами воды.
Железо-серный кластер очень чувствителен к воздействию супероксид иона и легко окисляется им.
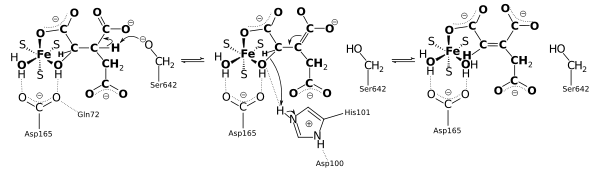
Механизм катализа
Аконитаза использует механизм гидратации-дегидратации[6]. Каталитическими остатками являются His-101 и Ser-642[6]. Остаток His-101 протонирует гидроксильную группу на C3 атоме цитрата, этот процесс позволяет покинуть молекулу воды, и Ser-642 одновременно атакуют протон на C2, образуя двойную связь между C2 и C3, что приводит к образованию цис-аконитатного интермедиата. В этот момент образовавшийся интермедиат поворачивается на 180°, происходит так называемый «флип-переход»[6][7][8].
Как именно происходит процесс флип-перехода спорно. Одна из теорий заключается в том, что на лимитирующей стадии механизма цис-аконитат высвобождается из фермента, а затем повторно присоединяется в форме изоцитрата для завершения реакции. Другая гипотеза заключается в том, что цис-аконитат остается связанным с ферментом, когда происходит флип-переход молекулы цитрата в форму изоцитрата[8][9][6].
В любом случае переворачивание цис-аконитата на 180° позволяет проводить стадии дегидратации и гидратации на противоположных сторонах интермедиата. Аконитаза катализирует транс-элиминирование/гидратацию, а флип-переход гарантирует правильное стереохимическое строение интермедиата. Чтобы завершить реакцию, остатки серина и гистидина изменяют свои изначальные каталитические функции:гистидин, являясь основанием, отщепляет протон из воды, тем самым он становится нуклеофилом для атаки на С2-атом, а протонированный серин депротонируется двойным цис-аконитом, завершая реакцию гидратации образованием молекулы изоцитрата[6].
Ингибирование катализа
Молекулы фторуксусной кислоты или фторацетата встраиваются в цикл Кребса, метаболизируются до фторцитрата, который оказывает сильное ингибируюшее воздействие на аконитазу, тем самым происходит блокирование цикла Кребса.
Примечания
- PDB 1ACO; Lauble, H; Kennedy, MC; Beinert, H; Stout, C.D. Crystal Structures of Aconitase with Trans-aconitate and Nitrocitrate Bound (англ.) // Journal of Molecular Biology : journal. — 1994. — Vol. 237, no. 4. — P. 437—451. — doi:10.1006/jmbi.1994.1246. — PMID 8151704.
- Beinert H., Kennedy M.C. Aconitase, a two-faced protein: enzyme and iron regulatory factor (англ.) // The FASEB Journal : journal. — Federation of American Societies for Experimental Biology, 1993. — December (vol. 7, no. 15). — P. 1442—1449. — PMID 8262329.
- Flint, Dennis H.; Allen, Ronda M. Iron−Sulfur Proteins with Nonredox Functions (англ.) // Chemical Reviews : journal. — 1996. — Vol. 96, no. 7. — P. 2315—2334. — doi:10.1021/cr950041r.
- Beinert H., Kennedy M.C., Stout C.D. Aconitase as Ironminus signSulfur Protein, Enzyme, and Iron-Regulatory Protein (англ.) // Chemical Reviews : journal. — 1996. — November (vol. 96, no. 7). — P. 2335—2374. — doi:10.1021/cr950040z. — PMID 11848830.
- Robbins A.H., Stout C.D. Structure of activated aconitase: formation of the [4Fe-4S] cluster in the crystal (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1989. — May (vol. 86, no. 10). — P. 3639—3643. — PMID 2726740.
- Takusagawa F. Chapter 16: Citric Acid Cycle. Takusagawa’s Note. The University of Kansas. Дата обращения: 10 июля 2011. Архивировано 24 марта 2012 года.
- Beinert H., Kennedy M.C., Stout C.D. Aconitase as Ironminus signSulfur Protein, Enzyme, and Iron-Regulatory Protein (англ.) // Chemical Reviews : journal. — 1996. — November (vol. 96, no. 7). — P. 2335—2374. — doi:10.1021/cr950040z. — PMID 11848830. Архивировано 11 августа 2011 года.
- Lauble H., Stout C.D. Steric and conformational features of the aconitase mechanism (англ.) // Proteins : journal. — 1995. — May (vol. 22, no. 1). — P. 1—11. — doi:10.1002/prot.340220102. — PMID 7675781.
- Aconitase family. The Prosthetic groups and Metal Ions in Protein Active Sites Database Version 2.0. The University of Leeds (2 февраля 1999). Дата обращения: 10 июля 2011. Архивировано 8 июня 2011 года.