Автоокисление
Автоокисление — процесс окисления органических соединений, самопроизвольно протекающий при их взаимодействии с кислородом воздуха.
История
Впервые процесс автоокисления бензальдегида в бензойную кислоту был описан химиками Юстусом Либихом и Фридрихом Вёлером в 1832 г. при изучении ими производных «горькоминдального» масла. В дальнейшем аналогичные реакции исследовали Кристиан Фридрих Шёнбейн, предложивший идею «активного кислорода», который образуется в реакциях окисления, Мориц Траубе, обнаруживший в продуктах автоокисления пероксид водорода, и Алексей Николаевич Бах и Карл Освальд Энглер, выдвинувшие концепцию образования пероксидов при окислении неорганических и органических веществ.
В 1927 г. Х. Бёкстрем доказал цепной механизм автоокисления сульфита и бензальдегида, а в 1934 г. он же предложил схему цепного механизма реакции. С 1940-х гг. проводилось изучение механизма реакций автоокисления и его стадий. К 1960-м гг. теория автоокисления была в основном сформирована и подтверждена многочисленными экспериментальными данными.
Также существовали иные теории автоокисления:
- Гидроксиляционная теория Бона
- Теория дегидрирования
- Альдегидная теория
Механизм реакции автоокисления
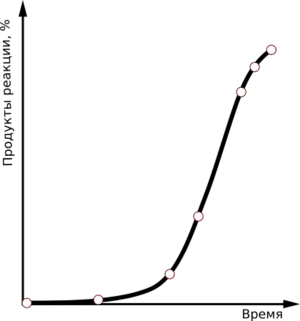
Реакции автоокисления органических соединений протекают по радикально-цепному механизму и включают в себя несколько стадий.
Зарождение цепей
При нормальных условиях связь C-C органических веществ достаточно устойчива, и зарождение цепей с гомолитическим разрывом этой связи по реакции
как правило не происходит. Поэтому зарождение цепи возможно с участием кислорода и инициирующих добавок с атакой наиболее слабой C-H связи:
Для легко окисляющихся веществ возможно зарождение цепи по тримолекулярной реакции
Обе эти реакции эндотермичны.
Кинетическая кривая накопления продуктов автоокисления характеризуется длительным периодом индукции, когда в реакционной смеси медленно нарастает концентрация пероксидов, а затем скорость реакции начинает резко возрастать, но потом начинает убывать. Таким образом формируется S-образная кривая.
Процесс автоокисления значительно ускоряется в присутствии радикальных инициаторов (например, пероксидов, азосоединений) либо при воздействии светового либо ионизирующего излучения. Наличие в реакционной среде металлов переменной валентности также ускоряет начало процесс автоокисления. В этом случае период индукции уменьшается.
Развитие цепей
Реакция присоединения молекулы кислорода к образовавшемуся углеводородному радикалу с образованием пероксидного радикала протекает в диффузионном режиме:
В то же время реакция развития цепи с образованием гидропероксида
является лимитирующей. Реакция ускоряется в полярных растворителях вследствие сольватации пероксидных радикалов и переходного состояния и в ароматических растворителях вследствие образования донорно-акцепторных комплексов.
Пероксидный радикал может атаковать как соседнюю молекулу углеводорода, так и C-H связь своей молекулы. В последнем случае образуются двухатомные гидропероксиды.
В случае наличия в молекуле углеводорода двойной C=C связи пероксидный радикал может присоединиться к ней, и тогда образуются полимерные пероксиды
Вырожденное разветвление цепей
Образовавшиеся гидропероксиды могут подвергаться гомолитическому распаду по O-O связи с образованием двух радикалов:
Данный процесс называется вырожденным разветвлением цепи и приводит к ускорению процесса окисления:
Протекают также другие реакции вырожденного разветвления цепей:
Обрыв цепи
Для обрыва цепи в жидкофазном окислении углеводородов необходима рекомбинация активных радикалов. Как правило, протекают три типа реакций рекомбинации (квадратичный обрыв) с образованием молекулярных продуктов:
При большом содержании кислорода в системе обрыв цепи проходит преимущественно по последней реакции.
Влияние катализаторов
Жидкофазное автоокисление углеводородов ускоряется в присутствии ионов металлов переменной валентности в связи с тем, что они катализируют разложение гидропероксидов (цикл Габера — Вейса):
Скорость этих окислительно-восстановительных реакций выше, чем реакция гидропероксидов с C-H и π-C-C связями алкенов, что и ускоряет процесс автоокисления. Образовавшиеся ионы металлов в высоких степенях окисления восстанавливаются продуктами реакции (спиртами, альдегидами и др.).
Ионы ряда металлов (кобальта, марганца, церия) катализируют гомолитический распад гидропероксидов с очень большим выходом (до 100 %), другие металлы (ванадий, хром, молибден) вызывают разложение гидропероксидов по гетеролитическому механизму без образования радикалов.
Влияние ингибиторов
Введение ингибиторов позволяет существенно замедлить радикально-цепные процессы. Применительно к реакциям автоокисления углеводородов по механизму действия ингибиторы подразделяются на 3 класса:
- Ингибиторы, взаимодействующие с пероксидными радикалами
К таким ингибиторам относятся фенолы, ароматические амины, аминофенолы, гидроксиламины, а также полициклические ароматические углеводороды. Эти вещества способны обрывать 2 цепи цепного процесса с образованием малоактивного радикала и молекулярных продуктов:
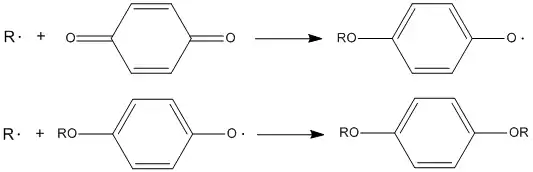
- Ингибиторы, взаимодействующие с алкильными радикалами
Такими ингибиторами служат хиноны, нитроксильные радикалы, иод:
- Ингибиторы, реагирующие с гидропероксидами
Скорость реакции автоокисления углеводородов возрастает при увеличении в них концентрации гидропероксидов, поэтому при добавлении веществ, реагирующих с гидропероксидами (например, сульфидов, дисульфиды) с образованием молекулярных продуктов, процессы автоокисления существенно замедляются:
Ингибирования процессов автоокисления удаётся добиться при добавлении комплексообразователей, дезактивирующих металлы вследствие образования прочных комплексов, например, диаминов и оксикислот.
Продукты реакции
Состав продуктов реакции автоокисления зависит от строения исходного углеводорода. Основными продуктами реакции являются пероксид водорода, органические гидропероксиды и пероксиды различного состава, а также продукты их распада — спирты, гликоли, альдегиды, кетоспирты, кетоны, карбоновые кислоты, оксикислоты, вода и др., а также продукты распада углеводородов с разрывом C-C связей. При наличии в молекулах органических соединений других функциональных групп образуются также продукты их окисления, например, органические сульфиды превращаются в соответствующие сульфоксиды и сульфоны, алкены — в эпоксиды (оксираны). Накопление в реакционной массе продуктов окисления, являющихся ингибиторами окисления, при степени превращения 40-50 % приводит к самоторможению процесса автоокисления.
Самовозгорание углеводородов
При большой площади соприкосновения с воздухом углеводороды (масла, жиры, олифы) способны самовоспламеняться вследствие протекания экзотермических процессов автоокисления. Так, в случае хранения пропитанных маслом ваты, ветоши, пористых материалов таким образом, чтобы поверхность окисления была больше поверхности теплоотдачи, они постепенно разогреваются и самовоспламеняются. Индукционный период составляет от нескольких часов до несколько дней. В присутствии солей марганца, свинца, кобальта (входят в состав сиккативов) индукционный период заметно сокращается. Это обусловливает особые требования к пожарной безопасности при хранении промасленной ветоши[1].
Примечания
- РД 153.-34.0-03.301-00 Правила пожарной безопасности для энергетических предприятий
Литература
- Е. Т. Денисов, О. М. Саркисов, Г. И. Лихтенштейн. Химическая кинетика. — М.: Химия, 2000. — 568 с. — 1000 экз. — ISBN 5-7245-1062-6.
- Н. М. Эмануэль, Г. Е. Заиков, З. К. Майзус. Роль среды в радикально-цепных реакциях окисления органических соединений. — М.: Наука, 1973. — 279 с. — 2250 экз.
- Е. Т. Денисов. Кинетика гомогенных химических реакций. — М.: Высшая школа, 1988. — 391 с. — 6000 экз. — ISBN 5-06-001337-5.
- К. И. Иванов. Промежуточные продукты и промежуточные реакции окисления углеводородов. — М., Ленинград: Гостоптехиздат, 1949. — 192 с. — 1100 экз.
- Демидов П. Г., Шандыба В. А., Щеглов П. П. Горение и свойства горючих веществ. — М.: Химия, 1981. — 272 с. — 20 000 экз.
