Органические гидропероксиды
Органические гидропероксиды — соединения состава ROOH, содержащие пероксидную группу O−O и являющиеся органическими производными пероксида водорода, в молекуле которого один из атомов водорода замещён на углеводородный радикал R.
Строение
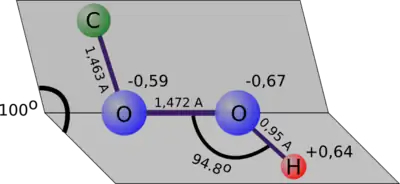
В гидропероксидах углеводородный радикал (алкильный, алкенильный, арильный и др.) соединён с гидропероксидной группой OOH, которая определяет физические и химические свойства гидропероксидов. Прочность связи O−O ~160-200 кДж/моль уступает прочности связей O−H (~480 кДж/моль), O−C (~380 кДж/моль) и сопоставима с прочностью связи O−N (~155 кДж/моль), что указывает на её высокую реакционную способность. Каждый атом кислорода пероксидной группы имеет по неподелённой электронной паре, которые отталкиваются друг от друга и взаимодействуют с электронными облаками соседних групп, образуя неплоскую конфигурацию R−O−O−H. Так, в молекуле трет-бутилгидропероксида угол O−O−H составляет 100°, длина связи C−O 1,463 Å, длина связи O−O 1,472 Å. Неподелённые электронные пары атомов кислорода способны образовывать комплексы с катионами и электрофильными веществами, и в то же время гидропероксидная группа сама является слабым электрофильным агентом.
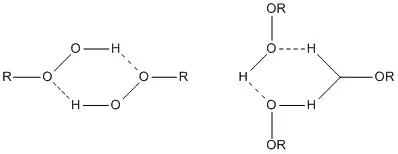
Полярность связи O−H приводит к тому, что органические гидропероксиды способны образовывать внутри- и межмолекулярные водородные связи. В частности, в растворах гидропероксиды могут образовывать димеры и тримеры:
В растворах гидропероксиды образуют ассоциаты с молекулами веществ-акцепторов водорода, например, со спиртами, с простыми и сложными эфирами, кетонами. Образование подобных ассоциатов оказывает влияние на механизм реакции гидропероксидов с этими веществами.
Физические свойства
Низшие алкилгидропероксиды представляют собой бесцветные жидкости, с более высокой молекулярной массой — кристаллические вещества.
Химические свойства
Кислотные свойства
Гидропероксидная группа OOH имеет более полярную связь O−H, нежели спиртовая, поэтому кислотность гидропероксидов выше, чем аналогичных спиртов:
| R | pKa (ROH) | pKa (ROOH) |
|---|---|---|
| CH3− | 15,5 | 11,5 |
| C2H5− | 15,9 | 11,8 |
| (CH3)2CH− | 16,5 | 11,8 |
| (CH3)3C− | 16,54 | 12,8 |
По кислотности гидропероксиды сопоставимы с фенолами и способны образовывать соли с щелочами (органические пероксиды металлов):
Это свойство используется для выделения и очистки гидропероксидов.
Окислительные свойства
Вследствие наличия атомов кислорода в промежуточной степени окисления −1 гидропероксиды проявляют окислительные свойства, в частности, способны окислять ионы металлов переменной валентности:
Гидропероксиды способны окислять органические соединения:
- органические сульфиды окисляются в сульфоксиды и сульфоны:
- триалкилфосфиты окисляются до триалкилфосфатов:
Термолиз
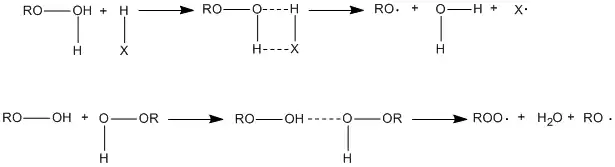
Термический распад органических гидропероксидов может протекать по мономолекулярному механизму по связи O−O:
Процесс осложняется образованием ассоциатов молекул гидропероксида как друг с другом, так и с молекулами растворителя, и бимолекулярный распад гидропероксидов протекает быстрее:
где HX — алканы, алкены, амины, спирты и др. Так, при малых концентрациях гидропероксидов их распад протекает по кинетическому уравнению первого порядка, при повышении концентрации — по уравнению второго порядка.
Термолиз гидропероксидов осложняется реакциями индуцированного распада, вовлечением молекул растворителя HSol и цепным процессом разложения:
При добавлении акцепторов свободных радикалов индуцированный распад подавляется.
При распаде первичных гидропероксидов образуются первичные спирты, распад вторичных гидропероксидов приводит к вторичным спиртам и кетонам, третичные гидропероксиды разлагаются с разрывом связи C−C, например, гидропероксид кумола превращается в ацетон и фенол.
Получение
Автоокисление углеводородов
Органические пероксиды образуются в ходе автоокисления углеводородов по общей схеме радикального цепного процесса:
В частности, таким способом получают гидропероксид кумола: водную эмульсию кумола окисляют кислородом воздуха при pH = 8,5—10,5, инициатором может служить азобисизобутиронитрил.
Синтез с пероксидом водорода
Ряд органических гидропероксидов можно получить взаимодействием пероксида водорода с галогеналканами, алкенами, спиртами, органическими сульфатами, метансульфонатами:
Замещение атома галогена на гидропероксидную группу протекает по механизму SN2 и проходит тем легче, чем слабее связь C−Hal:
Синтез с реактивами Гриньяра
Медленное окисление разбавленных (~ 0,5 н.) реактивов Гриньяра кислородом воздуха при низких температурах (~ −70 °C) позволяет получить гидропероксиды с большим выходом:
Применение
Органические гидропероксиды применяются в качестве
- окислителей в препаративном синтезе, например, при получении эпоксидов (оксиранов)
- инициаторов радикальной полимеризации
Литература
- В. Л. Антоновский, С. Л. Хурсан. Физическая химия органических пероксидов. — М.: ИКЦ «Академкнига», 2003. — 391 с. — 400 экз. — ISBN 5-94628-126-7.
- О. П. Яблонский, В. А. Беляев, А. Н. Виноградов. Ассоциация гидроперекисей углеводородов // Успехи химии. — Российская академия наук, 1972. — Т. 61, № 7. — С. 1260—1276.
- С. В. Завгородний. Гидроперекиси алкилароматических углеводородов и их производных // Успехи химии : журнал. — Российская академия наук, 1961. — Т. 30, № 3. — С. 1260—1276.
- А. И. Рахимов. Химия и технология органических перекисных соединений. — М.: «Химия», 1979. — 392 с. — 2900 экз.
- Э. Дж. Э. Хавкинс. Органические перекиси, их получение и реакции. — М., Ленинград: «Химия», 1961. — 536 с. — 4000 экз.