NOx (оксиды азота)
NOx — собирательное название оксидов азота NO и NO2, образующихся в химических реакциях в атмосфере и при горении. Вместе с летучими органическими веществами, приповерхностным озоном, свинцом, угарным газом, оксидами серы и пылевыми частицами входят в число вредных выбросов, в отношении которых действуют установленные Управлением по защите окружающей среды США ограничения[1].
NOx в атмосфере образуются как вследствие естественных явлений, таких как молнии и лесные пожары, так и в результате деятельности человека. Примеси NO2 окрашивают промышленные дымы в бурый цвет, поэтому выбросы заводов с заметным содержанием оксидов азота названы «лисьими хвостами». Выбросы NOx считаются одной из основных причин образования фотохимического смога. Соединяясь с парами воды в атмосфере, они образуют азотную кислоту, и, вместе с оксидами серы, являются причиной образования кислотных дождей. Повышенные концентрации NOx оказывают вредное воздействие на здоровье человека, поэтому в разных странах приняты нормативы, ограничивающие максимально допустимые концентрации NOx в выхлопах котлов электростанций, газотурбинных установок, автомобилей, самолётов и прочих устройств. Совершенствование технологий горения в значительной степени направлено на сокращение выбросов NOx при одновременном повышении энергоэффективности устройств.
Закись азота N2O не включается в NOx, но оказывает влияние на состояние озонового слоя в верхних слоях атмосферы.
Воздействие NOx на здоровье
NO не имеет запаха, но при вдыхании может связываться с гемоглобином, подобно угарному газу переводя его в форму, не способную переносить кислород[2]. Оксид азота (IV) NO2 (диоксид азота; двуокись азота) в высоких концентрациях раздражает лёгкие и может привести к серьёзным последствиям для здоровья. NO2 соединяется с водой, хорошо растворяется в жире и может проникать в капилляры лёгких, где он вызывает воспаление и астматические процессы. Концентрация NO2 свыше 200 ppm считается летальной, но уже при концентрации свыше 60 ppm могут возникать неприятные ощущения и жжение в лёгких. Долговременное воздействие более низких концентраций может вызывать головную боль, проблемы с пищеварением, кашель и лёгочные заболевания.
В клинике острого отравления оксидами азота различают четыре периода: латентный, нарастания отёка лёгких, стабилизации и обратного развития[3]. В скрытом периоде мнимого благополучия, который может продолжаться 4—12 часов, больного может беспокоить конъюнктивит, ринит и фарингит за счёт раздражения слизистых оболочек, проявляющиеся кашлем, слезотечением, общим недомоганием, однако его общее состояние в целом удовлетворительное[3]. Затем состояние больного ухудшается: по мере развития отёка лёгких появляется влажный кашель со слизистой или кровянистой мокрота, одышка, цианоз, тахикардия, субфебрильное или фебрильное повышение температуры. Возникает чувство страха, психомоторное возбуждение и судороги. В отсутствие квалифицированной медицинской помощи это может привести к летальному исходу.
Повышенная концентрация оксидов азота и озона оказывает негативное воздействие на насекомых-опылителей — пчёл, шмелей, бабочек, мотыльков. Снижается как их численность, так и посещаемость цветков растений опылителями, что может представлять опасность для урожайности культур. При этом другие насекомые — жуки, осы-паразиты и клопы — не ощущают отрицательных последствий от воздействия повышенных концентраций оксидов азота[4].
Механизмы образования NOx

Известны три основных механизма образования NOx[5]:
- тепловой механизм, или высокотемпературный механизм Зельдовича
- «быстрый» механизм (англ. prompt NO), называемый также химическим
- механизм, связанный с образованием NOx из азотсодержащих компонентов топлива («топливные NOx», англ. fuel NO)
Дополнительные пути образования NO связаны с реакциями закиси азота N2O и радикала NNH[6].
Механизм Зельдовича
Высокотемпературный механизм окисления азота в зоне горения был предложен Я. Б. Зельдовичем в середине 1940-х годов[7] и считается основным механизмом образования оксидов азота при горении. Этот механизм включает следующие элементарные стадии:
к которым добавляется реакция (Фенимор и Джонс, 1957[8]):
Совокупность реакций (1-3) называется расширенным механизмом Зельдовича. В силу того что энергия тройной связи в молекуле N2 составляет около 950 кДж/моль, реакция (1) имеет большую энергию активации и может проходить с заметной скоростью только при высоких температурах. Поэтому этот механизм играет важную роль в случае высоких температур в зоне реакции, например, при горении околостехиометрических смесей или при диффузионном горении. Считается, что повышение максимальной температуры в зоне горения свыше 1850 К приводит к недопустимо высоким выбросам NOx, и одним из основных способов снижения выбросов по тепловому механизму является недопущение образования очагов высокой температуры во фронте пламени.
«Быстрый» механизм
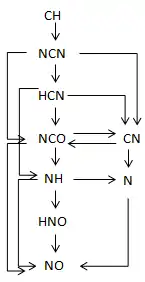
Механизм Зельдовича хорошо описывает выбросы NOx в случае воздействия тепловых факторов (например, при горении водорода или окиси углерода в воздухе), однако для углеводородных топлив оказалось, что экспериментально измеренные концентрации NOx всякий раз заметно превышают предсказываемые по тепловому механизму. Прямые измерения, проведённые Фенимором в 1971 году, показали, что NO образуется уже в начале зоны химической реакции[9]. Этот механизм был назван «быстрым» (англ. prompt NO) или механизмом Фенимора.
Образование NOx по быстрому механизму связано с реакцией радикала CH, который присутствует только в начальной зоне разложения углеводородных топлив, с молекулярным азотом:
NO может образовываться в ряде последующих реакций с участием различных радикалов, например:
Общая схема реакций быстрого механизма показана на рисунке.
Долгое время считалось, что вместо реакции (4) радикал CH реагирует с N2 по пути[10]:
однако данная реакция запрещена по спину[11], и проведённые в последние годы квантовохимические расчёты и экспериментальные исследования показали, что главную роль играет реакция (4)[12][13].
Поскольку в быстром механизме реакция (4) протекает с небольшой энергией активации, она возможна при относительно невысоких температурах порядка 1000 К, а в богатых смесях (с избытком горючего) образованию NO способствует повышенная концентрация радикалов CH.
Образование NOx из азотсодержащих компонентов топлива
Практически все твёрдые горючие материалы содержат органические вещества, в составе которых есть азот. Уголь, сено, дерево и домашний мусор могут содержать до 1-3 % азота по массе. При пиролизе и горении таких материалов в результате разложения этих компонентов может образовываться NO. Часть азота может переходить в N2 или оставаться в связанном состоянии в золе, смолах и других нелетучих остатках. Поскольку процессы сжигания угля и других твёрдых горючих материалов проходят при относительно невысоких температурах, когда механизм Зельдовича не работает, вклад данного механизма в выбросы и NOx может оказаться существенным[14].
Способы снижения выбросов NOx
Поскольку основная масса выбросов NOx в реальных устройствах приходится на высокотемпературный механизм Зельдовича, большинство разработанных к настоящему времени способов снижения этих выбросов направлено на снижение максимальной температуры в зоне горения и на сокращение времени пребывания реагентов в этой зоне. Способы снижения выбросов NOx подразделяются на первичные и вторичные[15]. К первичным относятся меры по оптимизации процесса горения и конструкции устройств, в результате которых снижается концентрация NOx в выхлопных газах. Вторичные способы (селективное или неселективное каталитическое восстановление) подразумевают очистку выхлопных газов перед их выбросом в атмосферу и влекут за собой существенные дополнительные затраты. Фактически применяемые способы в значительной степени обусловлены существующими в различных странах нормативами на выбросы NOx в промышленных установках (газотурбинные электростанции, промышленные печи), самолётах, автомобилях и устройствах для потребительского сектора, таких как бойлеры или нагреватели. Чем более жёсткие нормы установлены для выбросов, тем дороже оказывается конструкция камеры сгорания и сложнее управление её рабочим процессом.
Впрыск водяного пара
В установках с диффузионным режимом горения окислитель и горючее подаются раздельно в камеру сгорания, где они перемешиваются и сгорают. Такая организация подачи компонентов относительно безопасна и позволяет управлять рабочим процессом в широких пределах, варьируя расход компонентов. Однако в диффузионном пламени в зоне горения окислитель и горючее автоматически оказываются в стехиометрическом соотношении и неизбежно образуются очаги повышенной температуры, что приводит к образованию NOx. Снижение выбросов в таких установках достигается посредством разбавления смеси охлаждающим компонентом, чаще всего впрыском воды или водяного пара в камеру сгорания. Однако этот способ неизбежно приводит к снижению мощности и КПД установки, а его применимость ограничена тем, что вместе с сокращением NOx начинают возрастать выбросы CO и других продуктов неполного сгорания[16].
Многоступенчатое сжигание
Для снижения температуры в зоне химической реакции компоненты можно сжигать в несколько этапов. Например, на первом этапе может сжигаться богатая смесь (с избытком горючего) с последующим охлаждением продуктов неполного сгорания посредством теплоотводящих элементов. На втором и последующих этапах в смесь добавляется дополнительный воздух, который позволяет осуществить полное сгорание смеси до конечных продуктов сгорания (CO2 и H2O). При этом температура на всем протяжении зоны горения нигде не достигает величин, при которых образуются тепловые NOx, однако это достигается ценой снижения мощности установки и усложнения её конструкции.
Одним из наиболее распространённых вариантов технологии многоступенчатого сжигания является трёхступенчатое сжигание (англ. reburning process). Сущность этого метода заключается в том, что на первом этапе сжигается богатая смесь, на втором, основном этапе — смесь с избытком воздуха, а на третьем этапе в продукты сгорания снова добавляется углеводородное горючее, которое действует как восстановитель для уже образовавшихся в основной зоне горения оксидов азота. В результате этого происходит восстановление NOх до N2[17][18].
Рециркуляция выхлопных газов
Впрыск водяного пара или подача дополнительного воздуха в зону реакции сопряжёны с усложнением конструкции устройства и применяются в основном в системах, созданных до изобретения более простых и экономичных методов. В более современных системах в качестве разбавителя исходной смеси применяются сами продукты сгорания, отбираемые из потока дымовых или выхлопных газов. Эти продукты, состоящие в основном из CO2 и H2O, имеют высокую теплоёмкость и эффективно отбирают тепло из зоны реакции, снижая её температуру. Энергетическая эффективность установки снижается в меньшей степени, чем при подаче воздуха или водяного пара извне, так как энергия продуктов сгорания частично возвращается в систему. Конструкция самой установки упрощается, поскольку не требуется создавать отдельные узлы, обеспечивающие подачу внешних компонентов. Эти методы нашли применение как в автомобильных двигателях в системах рециркуляции выхлопных газов (англ. EGR, exhaust gas recirculation), так и в бойлерах и топочных устройствах (рециркуляция дымовых газов, англ. FGR, flue gas recirculation)[19].
Горение бедных смесей
Этот способ снижения выбросов нашёл широкое применение в газотурбинных установках. В камеру сгорания подаётся предварительно перемешанная смесь горючего и воздуха в нестехиометрическом отношении с избытком воздуха (бедная смесь). При этом обеспечивается практически полное сгорание исходного горючего, а температура продуктов сгорания снижается, что приводит также к сокращению выбросов NOx по высокотемпературному механизму. Если в качестве горючего применяется природный газ, то фактически все выбросы NOx приходятся на быстрый механизм.
Газотурбинные установки, использующие горение бедных смесей с низкими выбросами NOx, иногда называются «сухими» (англ. dry low NOx), поскольку в них впрыск водяного пара отсутствует. Однако диапазон устойчивого горения в таких установках заметно снижается, они подвержены опасностям развития неустойчивостей горения, проскока и срыва пламени[20]. Поэтому их диапазон по мощности ограничен, а резкие изменения нагрузки в сети приводили к авариям из-за веерного самопроизвольного выключения газотурбинных установок в сетях генерации мощности. Кроме того, диапазон устойчивого горения чувствителен к сорту топлива, и переход на топливо от другого поставщика может быть сопряжен со значительными трудностями, так как состав природного газа из различных месторождений сильно варьируется.
Селективное каталитическое восстановление
Метод селективного каталитического восстановления (СКВ, англ. selective catalytic reduction) применяется для очищения дымовых и выхлопных газов от NOx с эффективностью, доходящей до 90 %. В поток выхлопных газов инжектируется реагент, обычно аммиак или мочевина, и смесь поступает на катализатор. Катализатор работает в диапазоне температур от 450 до 900 К и обеспечивает протекание следующих реакций, в которых оксид азота восстанавливается до молекулярного азота:
в случае добавления аммиака и
в случае использования мочевины (более дорогостоящего реагента).
В катализаторах применяются оксид титана с добавками ванадия, молибдена или вольфрама, цеолиты, оксиды железа с тонкой плёнкой из фосфатов железа или активированный углерод в виде агломерированных гранул. Материал катализатора подбирается с учётом его цены и долговечности в заданных условиях эксплуатации[21].
Селективное некаталитическое восстановление
Метод селективного некаталитического восстановления (СНКВ, англ. selective non-catalytic reduction) получил широкое распространение в мировой энергетике и применяется в России на ТЭЦ. В этом методе в дымовые газы добавляется аммиак или мочевина, которые восстанавливают NO до молекулярного азота. Отказ от использования катализатора позволяет существенно удешевить процесс. Метод был запатентован компанией Exxon Research Engineering в 1975 году[22].
Метод применяется в температурном диапазоне примерно от 1100 до 1400 К и описывается брутто-реакцией
При более низких температурах реакция протекает слишком медленно, а при более высоких с ней начинает конкурировать реакция
Основная сложность в применении этого метода связана с необходимостью обеспечить смешение реагента с дымовыми газами именно в заданном температурном окне и пребывание в нём в течение 200—500 мс[23].
Примечания
- What Are the Six Common Air Pollutants? (англ.). U. S. Environmental Protection Agency. Дата обращения: 19 марта 2014.
- Stamler J. S., Gow A. J. Reactions between nitric oxide and haemoglobin under physiological conditions // Nature. — Macmillan Publishers Ltd, 1998. — Vol. 391, № 6663. — P. 169—173. — doi:10.1038/34402.
- Артамонова В. Г., Мухин Н. А., 2004, с. 351.
- Марина Попова. Оксиды азота и озон помешали насекомым-опылителям найти цветки. nplus1.ru. Дата обращения: 20 января 2022.
- Wünning and Wünning, Flameless oxidation, 1997, с. 82.
- Lefebvre, Ballal, Gas Turbine Combustion, 2010, с. 378.
- Зельдович и др., Окисление азота при горении, 1947.
- Fenimore C. P., Jones G. W. Nitric Oxide Decomposition at 2200–2400° K // The Journal of Physical Chemistry. — American Chemical Society, 1957. — Vol. 61, № 5. — P. 654—657. — doi:10.1021/j150551a034.
- Fenimore C. P. Formation of nitric oxide in premixed hydrocarbon flames // Symposium (International) on Combustion. — Elsevier, 1971. — Vol. 13, № 1. — P. 373—380. — doi:10.1016/S0082-0784(71)80040-1.
- Warnatz, Combustion, 2006, с. 262.
- Cui Q., Morokuma K., Bowman J. M., Klippenstein S. J. The spin-forbidden reaction CH(2Π)+N2→HCN+N(4S) revisited. II. Nonadiabatic transition state theory and application // The Journal of chemical physics. — American Institute of Physics, 1999. — Vol. 110, № 19. — P. 9469—9482. — doi:10.1063/1.478949.
- Moskaleva L. V., Lin M. C. The spin-conserved reaction CH+N2→H+NCN: A major pathway to prompt NO studied by quantum/statistical theory calculations and kinetic modeling of rate constant // Proceedings of the Combustion Institute. — Elsevier, 2000. — Vol. 28, № 2. — P. 2393—2402. — doi:10.1016/S0082-0784(00)80652-9.
- Lamoureux N., Desgroux P., El Bakali A., Pauwels J. F. Experimental and numerical study of the role of NCN in prompt-NO formation in low-pressure CH4–O2–N2 and C2H2–O2–N2 flames // Combustion and Flame. — Elsevier, 2010. — Vol. 157, № 10. — P. 1929—1941. — doi:10.1016/j.combustflame.2010.03.013.
- Glarborg e.a., Fuel nitrogen conversion, 2003, с. 91.
- Warnatz, Combustion, 2006, с. 267.
- Lefebvre, Ballal, Gas Turbine Combustion, 2010, с. 387.
- Smoot, Hill, Xu, NOx control through reburning, 1998, с. 386.
- Котлер В. Р. Трехступенчатое сжигание (недоступная ссылка). Дата обращения: 23 апреля 2014. Архивировано 24 апреля 2014 года.
- Котлер В. Р. Рециркуляция дымовых газов (недоступная ссылка). Дата обращения: 23 апреля 2014. Архивировано 6 марта 2016 года.
- Wünning and Wünning, Flameless oxidation, 1997, с. 84.
- Котлер В. Р. Селективное каталитическое восстановление — СКВ (SNR) (недоступная ссылка). Дата обращения: 23 апреля 2014. Архивировано 9 апреля 2014 года.
- Патент США № 3 900 554 от 19 августа 1975. Method for the reduction of the concentration of NO in combustion effluents using ammonia. Описание патента на сайте Ведомства по патентам и товарным знакам США.
- Котлер В. Р. Селективное некаталитическое восстановление — СНКВ (SNCR) (недоступная ссылка). Дата обращения: 8 апреля 2014. Архивировано 8 апреля 2014 года.
Литература
- Зельдович Я. Б., Садовников П. Я., Франк-Каменецкий Д. А. Окисление азота при горении. — М.—Л.: Издательство АН СССР, 1947. — 148 с.
- Warnatz J., Maas U., Dibble R. W. Combustion: Physical and Chemical Fundamentals, Modeling and Simulation, Experiments, Pollutant Formation. — Springer, 2006. — 378 p. — ISBN 978-3-540-45363-5. (англ.)
- Lefebvre A. H., Ballal D. R. Gas Turbine Combustion: Alternative Fuels and Emissions. 3rd Edition. — CRC Press, 2010. — 538 p. — ISBN 978-1420086041. (англ.)
- Артамонова В. Г., Мухин Н. А. Интоксикации веществами раздражающего действия (хлор, хлороводород, сернистый ангидрид, сероводород, оксиды азота) // Профессиональные болезни. — М.: Медицина, 2004. — 480 с. — 3000 экз. — ISBN 5-225-04789-0.
Обзоры
- Miller J. A., Bowman C. T. Mechanism and modeling of nitrogen chemistry in combustion (англ.) // Progress in Energy and Combustion Science. — Elsevier, 1989. — Vol. 15, no. 4. — P. 287–338. — doi:10.1016/0360-1285(89)90017-8.
- Wünning J. A., Wünning J. G. Flameless oxidation to reduce thermal NO-formation (англ.) // Progress in Energy and Combustion Science. — Elsevier, 1997. — Vol. 23, no. 1. — P. 83—94. — doi:10.1016/S0360-1285(97)00006-3.
- Smoot L. D., Hill S. C., Xu H. NOx control through reburning (англ.) // Progress in Energy and Combustion Science. — Elsevier, 1998. — Vol. 24, no. 5. — P. 385–408. — doi:10.1016/S0360-1285(97)00022-1.
- Glarborg P., Jensen A. D., Johnsson J. E. Fuel nitrogen conversion in solid fuel fired systems (англ.) // Progress in Energy and Combustion Science. — Elsevier, 2003. — Vol. 29, no. 2. — P. 89—113. — doi:10.1016/S0360-1285(02)00031-X.
- Konnov A. A., Javed M. T., Kassman H., Irfan N. NOx Formation, Control and Reduction Techniques (англ.) // Handbook of Combustion. Volume 2: Combustion Diagnostics and Pollutants. — Wiley, 2010. — P. 439–464. — doi:10.1002/9783527628148.hoc037.
- Glarborg P., Miller J. A., Ruscic B., Klippenstein S. J. Modeling nitrogen chemistry in combustion // Progress in Energy and Combustion Science. — 2018. — Vol. 67. — P. 31—68. — ISSN 0360-1285. — doi:10.1016/j.pecs.2018.01.002.
Ссылки
- Химия NOx — видеозапись лекции профессора Майкла Пиллинга на летней школе по горению 2013 года в Принстонском университете (на английском языке, слайды к лекции).