Фотодыхание
Фотодыхание (гликолатный путь, С2-фотосинтез) — стимулируемое светом выделение углекислого газа и поглощение кислорода у растений преимущественно с С3-типом фотосинтеза. Также под фотодыханием понимают биохимический путь, связанный с регенерацией одной молекулы 3-фосфоглицериновой кислоты (С3) из двух молекул гликолевой кислоты (С2) и лежащий в основе вышеописанного газообмена. Наличие биохимического механизма фотодыхания обусловлено значительной оксигеназной активностью РуБисКО, ключевого фермента цикла Кальвина.

Поглощение кислорода в ходе фотодыхания обусловлено оксигеназной активностью РуБисКО в хлоропластах и работой оксидазы гликолевой кислоты в пероксисомах. Кроме того, окисление образовавшегося в митохондриях НАДН также сопряжено с поглощением кислорода. Выделение углекислого газа (С1) при фотодыхании происходит в митохондриях и связано с конденсацией двух молекул глицина (С2) с образованием одной молекулы серина (С3) (последовательная работа двух ферментов: глициндекарбоксилазы и серингидроксиметилтрансферазы). Также в реакции конденсации глицина в митохондриях выделяется аммиак, который реутилизируется в результате работы глутаминсинтетазы и глутаминоксоглутаратаминотрансферазы (ГС/ГОГАТ-путь). При фотодыхании расходуется АТФ (не происходит запасания энергии) синтезированный в ходе фотофосфорилирования. Также окисление гликолевой кислоты в пероксисомах в ходе фотодыхания служит основным источником токсичного пероксида водорода в фотосинтезирующей растительной клетке.
История
Первые свидетельства фотодыхания были получены в 1920 г. немецким биохимиком Отто Варбургом[1]. При исследовании водорослей рода Chlorella было показано ингибирование фотосинтеза (поглощения углекислого газа) при повышении концентрации кислорода. Этот эффект наблюдался как при высоких, так и при низких интенсивностях света и позднее получил название эффекта Варбурга[2][3] .
Газообмен и отличия от темнового дыхания
Суммарное поглощение кислорода на свету определяется интенсивностью двух процессов: темновым дыханием и светоиндуцируемым дыханием, связанным с фотохимическими реакциями хлоропластов. Фотодыхание активируется при высоких интенсивностях света, в то время как процессы темнового дыхания растений подавляются на свету. Фотодыхание увеличивается при повышении концентрации кислорода от 0 до 100 %, а темновое дыхание насыщается уже при 2 % кислорода[4][5]. В отличие от темнового дыхания процесс поглощения кислорода при фотодыхании не ингибируется типичными дыхательными ядами, например азидом натрия (ингибитор цитохромоксидазы митохондрий).
Взаимодействие органелл при фотодыхании
Осуществление реакций фотодыхания требует тесного взаимодействия трёх органелл растительной клетки: хлоропластов, пероксисом и митохондрий. Выявлен один из интегральных пероксинов PEX10 мембраны пероксисом, обеспечивающий взаимодействие и близкий контакт пероксисомы и хлоропласта[6][7]. Принципиальным для взаимодействия органелл оказывается C3HC4 (Цис3-Гис-Цис4) RING цинковый палец белка PEX10. Мутация, нарушающая функцию данного домена, оказывается летальной для эмбриона растения на стадии сердца. Рост и развитие у сублетальных мутантов по белку PEX10 нормализуются в условиях обогащенной CO2 среды. В нормальной атмосфере у сублетальных pex10 наблюдается повышенное содержание глиоксилата, сниженное содержание каротиноидов, хлорофиллов a и b, а также сниженный квантовый выход фотосистемы II. При электронной микроскопии наблюдаются изменения в строении пероксисом, а также их разобщенность с хлоропластами[7]. В то же время, точечные мутации в мотиве TLGEEY приводят к формированию нитевидных пероксисом, но при этом не нарушается их ассоциация с хлоропластами[8]. Таким образом, PEX10 контролирует не только ассоциацию пероксисом с хлоропластами, но также их строение.
Субстратная специфичность Рубиско

Рибулозобисфосфаткарбоксилаза/оксигеназа (Рубиско) — ключевой фермент фотосинтеза, катализирует две конкурирующие реакции: карбоксилирование и оксигенирование пятиуглеродного сахара рибулозо-1,5-бисфосфата (РуБФ). Молекула кислорода (как и углекислого газа) присоединяется к связанной с ферментом ендиольной форме РуБФ, которая существует вследствие кето-енольной изомерии. Константа Михаэлиса (концентрация полунасыщения) для углекислого газа гораздо ниже (9 мкМ), чем для кислорода (535 мкМ), то есть сродство фермента к углекислому газу значительно выше[9]. Тем не менее скорость оксигеназной реакции высока, поскольку концентрация кислорода в атмосфере составляет 21 %, а углекислого газа — 0,04 %. Благодаря этому у С3-растений интенсивность фотодыхания может достигать 50 % от интенсивности фотосинтеза.
Химизм фотодыхания

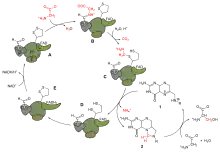
Из-за наличия оксигеназной активности у фермента рибулозобисфосфаткарбоксилазы, катализирующего присоединение CO2 к рибулозо-1,5-бифосфату на начальной стадии цикла Кальвина, вместо ассимиляции углекислоты под воздействием того же фермента происходит окисление рибулозофосфата с распадом его на 3-фосфоглицериновую кислоту, которая может поступить в цикл, и на фосфат гликолевой кислоты. Он дефосфорилируется и гликолевая кислота транспортируется в пероксисомы, где окисляется до глиоксалевой кислоты и аминируется с получением глицина. В митохондриях из двух молекул глицина образуется серин и углекислый газ. Серин может использоваться для синтеза белка, либо превращается в 3-фосфоглицериновую кислоту и возвращается в цикл Кальвина.
Условия, стимулирующие фотодыхание
Очевидно, что снижение концентрации углекислого газа приводит к стимуляции фотодыхания. Как было сказано выше, фотодыхание интенсифицируется и при увеличении концентрации кислорода. Увеличение температуры приводит к снижению устойчивости ендиольного интермедиата реакции, катализируемой РуБисКО, что способствует реакции оксигенирования РуБФ. Помимо того, при повышении температуры растворимость углекислого газа уменьшается несколько сильнее растворимости кислорода (хотя и намного превышает её при любых температурах).
Биологическое значение фотодыхания
Хотя достоверно известно, что фотодыхание снижает эффективность фотосинтеза, приводит к потерям ассимилированного углерода, тем не менее вопрос о функциях фотодыхания остается дискуссионным. Основная гипотеза предполагает, что фотодыхание возникло как путь, служащий для оптимальной утилизации гликолата, образующегося в результате оксигеназной активности РуБисКО. При этом тот факт, что оксигеназная активность РуБисКО не была элиминирована в ходе эволюции, объясняется, по-видимому тем, что существующее соотношение карбоксилазной и оксигеназной активностей достигло предела, определяемого химизмом реакции и не может быть увеличено. Сравнительный анализ фермента разных организмов показывает, что РуБисКО существовала уже 3,5 млрд лет назад, когда в атмосфере было мало кислорода и уже к тому времени заняла ключевую позицию в цикле ассимиляции углерода при фотосинтезе. При этом её оксигеназная функция в условиях низкого содержания кислорода не играла существенной роли. По мере увеличения содержания кислорода потери ассимилированного углерода в результате фотодыхания нарастали, однако сложность строения РуБисКО, по-видимому, помешала эволюции каталитического центра устранить оксигеназную активность[9]. Данная гипотеза косвенно подтверждается отсутствием значительных успехов в попытках генноинженерным способом увеличить сродство РуБисКО к углекислому газу путём изменения аминокислотной последовательности активного центра фермента[10]. Фотодыхание, вследствие оксигеназной реакции РуБисКО, предотвращает исчерпание углекислого газа у активного центра этого фермента[11] и, в конечном итоге, регулирует содержание CO2 и O2 в биосфере[12][13].
В связи с тем, что фотодыхание снижает эффективность фотосинтеза, в ходе эволюции у ряда растений возникли минимизирующие фотодыхание механизмы, не связанные с модификацией РуБисКО. К таким механизмам относятся различные типы C4-фотосинтеза и CAM-фотосинтез. В этих биохимических путях первичную фиксацию углекислоты осуществляет фосфоенолпируваткарбоксилаза (ФЕП-карбоксилаза), что позволяет в конечном счёте концентрировать углекислоту в месте её ассимиляции в реакции карбоксилирования РуБФ, катализируемой РуБисКО.
См. также
Литература
- Джеймс В. Дыхание растений. - М., ИЛ, 1956. - 440 с.
- Физиология растений / под ред. И. П. Ермакова. — М. : «Академия», 2007. — 640 с. — ISBN 978-5-7695-36-88-5.
- Фотосинтез. Физиолого-экологические и биохимические аспекты / А.Т Мокроносов, В. Ф. Гавриленко, Т. В. Жигалова; под ред. И. П. Ермакова. — М. : «Академия», 2006. — 448 с. — ISBN 5-7695-2757-9
- Биохимия растений / Г.-В. Хелдт; пер. с англ. — М. : БИНОМ. Лаборатория знаний, 2011. — 471 с. — ISBN 978-5-94774-795-9
- Чиков В. И. Фотодыхание // Соросовский образовательный журнал, 1996, № 11, c. 2-8
- Plant Physiology, Fifth Edition — Sinauer Associates, Inc. Taiz and Zeiger. 2010.
Примечания
- Чиков В. И. Фотодыхание // Соросовский образовательный журнал, 1996, № 11, c. 2-8 (недоступная ссылка). Дата обращения: 27 января 2007. Архивировано 18 августа 2007 года.
- Turner J.S., Brettain E.G. Oxygen as a factor in photosynthesis (неопр.) // Biol Rev Camb Philos Soc. — 1962. — February (т. 37). — С. 130—170. — doi:10.1111/j.1469-185X.1962.tb01607.x. — PMID 13923215. (недоступная ссылка)
- Zelitch I. Chapter 8, Section E: Inhibition by O2 (The Warburg Effect) // Photosynthesis, Photorespiration, and Plant Productivity (англ.). — New York: Academic Press, 1971. — P. 253—255. — ISBN 0124316085.
- Физиология растений / под ред. И. П. Ермакова. — М. : «Академия», 2007. — 640 с. — ISBN 978-5-7695-36-88-5.
- Фотосинтез. Физиолого-экологические и биохимические аспекты / А.Т Мокроносов, В. Ф. Гавриленко, Т. В. Жигалова; под ред. И. П. Ермакова. — М. : «Академия», 2006. — 448 с. — ISBN 5-7695-2757-9
- Bob B. Buchanan, Wilhelm Gruissem, Russel L. Jones. Biochemistry & Molecular Biology of Plants. — Second Edition. — Chichester, West Sussex. — XV, 1264 с. — ISBN 9780470714218.
- Uwe Schumann, Jakob Prestele, Henriette O'Geen, Robert Brueggeman, Gerhard Wanner. Requirement of the C3HC4 zinc RING finger of the Arabidopsis PEX10 for photorespiration and leaf peroxisome contact with chloroplasts (англ.) // Proceedings of the National Academy of Sciences. — National Academy of Sciences, 2007-01-16. — Vol. 104, iss. 3. — P. 1069—1074. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.0610402104.
- Jakob Prestele, Georg Hierl, Christian Scherling, Stefan Hetkamp, Claus Schwechheimer. Different functions of the C3HC4 zinc RING finger peroxins PEX10, PEX2, and PEX12 in peroxisome formation and matrix protein import (англ.) // Proceedings of the National Academy of Sciences. — United States National Academy of Sciences, 2010-08-17. — Vol. 107, iss. 33. — P. 14915—14920. — ISSN 0027-8424. — doi:10.1073/pnas.1009174107.
- Биохимия растений / Г.-В. Хелдт; пер. с англ. — М. : БИНОМ. Лаборатория знаний, 2011. — 471 с. — ISBN 978-5-94774-795-9
- Spreitzer R.J., Salvucci M.E. Rubisco: structure, regulatory interactions, and possibilities for a better enzyme (англ.) // Annu Rev Plant Biol : journal. — 2002. — Vol. 53. — P. 449—475. — doi:10.1146/annurev.arplant.53.100301.135233. — PMID 12221984.
- A. U. Igamberdiev. Control of Rubisco function via homeostatic equilibration of CO2 supply // Frontiers in Plant Science. — 2015. — Т. 6. — ISSN 1664-462X. — doi:10.3389/fpls.2015.00106.
- N. E. Tolbert, C. Benker, E. Beck. The oxygen and carbon dioxide compensation points of C3 plants: possible role in regulating atmospheric oxygen (англ.) // Proceedings of the National Academy of Sciences. — National Academy of Sciences, 1995. — Vol. 92, iss. 24. — P. 11230—11233. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.92.24.11230.
- A. U. Igamberdiev, P. J. Lea. Land plants equilibrate O2 and CO2 concentrations in the atmosphere (англ.) // Drugs. — Adis International, 2006. — Vol. 87, iss. 2. — P. 177—194. — ISSN 1573-5079 0166-8595, 1573-5079. — doi:10.1007/s11120-005-8388-2.