Тетранитрид тетрасеры
Тетранитрид тетрасеры (циклотетратиазил, тиазен) — неорганическое соединение серы и азота с формулой S4N4, оранжево-жёлтые кристаллы, устойчивые на воздухе, возгоняются в вакууме, разлагаются горячей водой, при нагревании или ударе взрывается.
Тетранитрид тетрасеры | |
|---|---|
 | |
 | |
Общие | |
| Систематическое наименование | Тетранитрид тетрасеры |
| Традиционные названия | Азотистая сера |
| Хим. формула | N₄S₄ |
Физические свойства | |
| Состояние | оранжево-жёлтые кристаллы |
| Молярная масса | 184,29 г/моль |
| Плотность | 2,22 г/см³ |
Термические свойства | |
| Т. плав. | 178 ℃ |
| Т. кип. | 185 ℃ |
| Энтальпия образования | 460 кДж/моль |
Классификация | |
| Номер CAS | 28950-34-7 |
| PubChem | 141455 |
| ChemSpider | 124788 |
N1=S=NSN=S=NS1 | |
InChI=1S/N4S4/c1-5-2-7-4-8-3-6-1 | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Впервые соединение было получено в 1835 г. с примесями, однако только в 1851 г. был изучен стехиометрический состав. Структура соединения оставалась неизученной до 1944 г[1].
Получение
- Растворение серы в жидком аммиаке (с иодидом серебра реакция идёт быстрее):
- Действие азидом лития на дитиодихлорид (раствор в бензоле):
- Растворение дитиодихлорида в жидком аммиаке:
Физические свойства
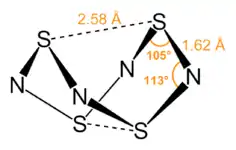
Тетранитрид тетрасеры образует оранжево-жёлтые кристаллы ромбической сингонии, пространственная группа P mmm, параметры ячейки a = 0,847 нм, b = 0,887 нм, c = 0,720 нм, Z = 4.
Тетранитрид тетрасеры проявляет термохромные свойства: его цвет меняется от бесцветного (при −100 °C)[2], светло-жёлтого (ниже −30 °C), оранжевого при комнатной температуре и до темно-красного выше 100 °C. Соединение термодинамически неустойчиво: при нагревании или ударе разлагается со взрывом. Чистые образцы более чувствительны к детонации; если ударить молотком по малым количествам вещества — оно взорвется[1].
Нерастворим в воде (при комн. темп.), растворяется в бензоле, тетрахлорметане[2].
Химические свойства
- При нагревании циклотетратиазила и использовании серебряной «ваты» образуется сульфид серебра(I), необходимый для получения динитрида дисеры в следующих (протекающих одновременно) реакциях[3]:
-
- Динитрид дисеры при комнатной температуре медленно самопроизвольно полимеризуется в твердом состоянии в политиазил[4]:
- При нагревании разлагается:
- Разлагается горячей водой:
- Реагирует с горячими концентрированными кислотами:
- Реагирует с щелочами:
- Реагирует с растворённой в сероуглероде серой:
- Является слабым окислителем:
Соединение является важным для получения других соединений серы с азотом[1].
Примечания
- Н. Н. Гринвуд, А. Эрншо, 1997, с. 722.
- Турова, 1997, с. 21.
- Н. Н. Гринвуд, А. Эрншо, 1997, с. 725.
- Н. Н. Гринвуд, А. Эрншо, 1997, с. 726.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Турова Н. Я. Неорганическая химия в таблицах. — М.: Высший химический колледж Российской академии наук, 1997. — 115 с.
- Н. Н. Гринвуд, А. Эрншо. Химия элементов = Chemistry of the Elements. — 2-е изд. — Butterworth-Heinemann, 1997. — ISBN 0080379419.