Теория валентных связей
Теория валентных связей (метод валентных связей, метод валентных схем, метод локализованных электронных пар) — приближённый квантовохимический расчётный метод, основанный на представлении о том, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар.
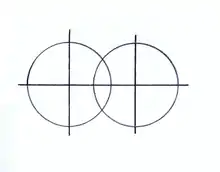
Теория валентных связей заложена в 1927 году В. Гайтлером и Ф. Лондоном на примере квантовохимического расчёта молекулы водорода. В основе теории валентных связей лежит гипотеза о том, что при образовании молекулы из атомов, последние в значительной мере сохраняют свою электронную конфигурацию, а связывание атомов достигается в результате обмена электронов между ними и спаривания спинов двух электронов, находящихся на атомных орбиталях исходных атомов. Расчёт Гайтлера — Лондона оказался весьма значительным по своим результатам в развитии квантовой химии. В подтверждение электронной октетной теории (правило октета) Г. Льюиса было показано, что химическая связь в молекуле водорода действительно осуществляется парой электронов.
Электронная пара оказывается размазанной по всему пространству молекулы с различной плотностью, причём на линии связи между ядрами имеется сгущение электронной плотности по сравнению с другими областями пространства. Это сгущение электронной плотности на линии, связывающей ядра атомов, вызывает стягивающее действие на ядра и, соответственно, приводит к образованию химической связи (рис. 1). Энергия связи определяется в основном обменным интегралом, величина которого существенно зависит от степени перекрывания атомных орбиталей атомов.
Гибридизация атомных орбиталей
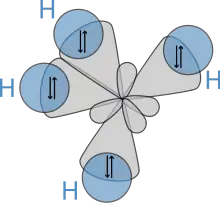
Представления о гибридизации атомных орбиталей занимают центральное место в теории валентных связей. Концепция гибридизации атомных орбиталей была предложена в 1931 году Л. Полингом для объяснения тетраэдрического строения соединений насыщенного атома углерода. По Полингу, смешанные, или гибридные орбитали углерода можно рассчитать с помощью простых алгебраических операций. Для этого важно учесть зависимость электронных s- и p- орбиталей от направления их в пространстве и сложить их так, чтобы гибридные орбитали приняли максимально вытянутую конфигурацию. В тех местах, где гибридные орбитали наиболее вытянутые, как раз и образуются химические связи между атомами. И связи эти направлены от ядра в углы правильного тетраэдра (рис. 2).
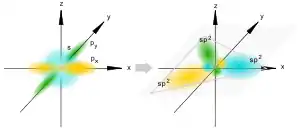
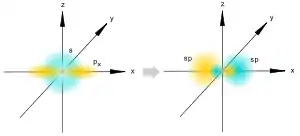
Позднее Полинг распространил идею гибридизации и на ненасыщенные органические соединения. Так возникли различные виды гибридизации: sp3 — гибридизация используется для описания предельных органических соединений — алканов; sp2 — гибридизация используется для описания непредельных соединений, содержащих двойную связь — алкенов (рис.3); sp — гибридизация используется для описания непредельных соединений, содержащих тройную связь — алкинов (рис.4). Сама гибридизация атомных орбиталей не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить распределение электронной плотности в молекулах при образовании ковалентной химической связи.
Резонанс канонических структур
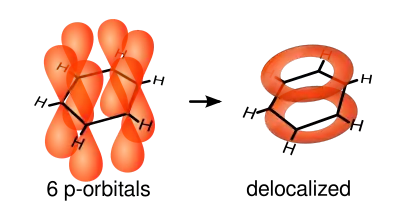
Резонанс канонических структур — концепция, утверждающая, что если для данного соединения существует несколько приемлемых формул, то действительная структура молекулы определяется сочетанием формул (наложение, резонанс структур). Теория резонанса была развита Полингом в 1928—1931 годах. К теории резонанса тесно примыкает мезомерный эффект — теория электронного строения химических соединений, согласно которой истинное распределение электронной плотности в молекуле является промежуточным между распределениями, представленными несколькими классическими формулами. Для отображения равноудалённости всех связей ввели предположение о делокализации π-связи (π-электронного облака) и отрицательного заряда на все атомы, составляющие молекулу. В качестве примера с делокализованными π-связями обычно приводят молекулу бензола (рис.5).
Взгляды Полинга на квантовую механику применительно к химии, представляющие гибридизацию атомных орбиталей, резонанс нескольких электронных структур, нашли отражение в его монографии «Природа химической связи».[1]
Лайнус Карл Полинг становится лауреатом Нобелевской премии по химии за 1954 год с формулировкой «За исследование природы химической связи и её применение для определения структуры соединений».
Теория валентных связей оставалась умозрительной, физический смысл избирательной гибридизации был неясным. Теория валентных связей не позволяла объяснить образование одноэлектронной химической связи, трёхцентровой двухэлектронной химической связи, многоцентровых химических связей в некоторых металлороганических соединениях.
В настоящее время в квантовой химии доминирует теория молекулярных орбиталей, развитая Р. Малликеном.
В методе молекулярных орбиталей молекула рассматривается как одно целое (учитывается притяжение электрона ко всем ядрам), а не как совокупность отдельных связей. В 1966 году Малликену присуждена Нобелевская премия по химии с формулировкой «За фундаментальную работу по химическим связям и электронной структуре молекул, проведённую с помощью метода молекулярных орбиталей».
Примечания
- Паулинг Л. Природа химической связи / Пер. с англ. М. Е. Дяткиной. Под ред. проф. Я. К. Сыркина. — М.; Л.: Госхимиздат, 1947. — 440 с.
Литература
- Паулинг Л. Теория резонанса в химии / ЖВХО. — 1962. — Т. VII. — 462-467 с.
- Быков Г.В. История органической химии (Структурная химия. Физическая органическая химия. Расчётные методы). — М.: "Химия", 1976. — 360 с.