Сульфат кальция
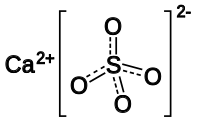
Сульфа́т ка́льция (CaSO4) — неорганическое соединение, кальциевая соль серной кислоты.
| Сульфат кальция | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Сульфат кальция |
| Традиционные названия | кальций сернокислый, "ангидрит", гипс, алебастр, селенит |
| Хим. формула | CaSO4 |
| Физические свойства | |
| Состояние | кристаллическое |
| Молярная масса | 136,1406 г/моль |
| Плотность | 2,96 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 1450°C (с частичным разложением) |
| • разложения | 1560°C |
| Мол. теплоёмк. | 99.660 Дж/(моль·К) |
| Энтальпия | |
| • образования | −1434,5 кДж/моль |
| Удельная теплота плавления | 28 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст.[1] |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,2036 г/100 мл воды |
| Классификация | |
| Рег. номер CAS | 7778-18-9 |
| PubChem | 24497 |
| Рег. номер EINECS | 231-900-3 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E516 |
| RTECS | WS6920000 |
| ChEBI | 31346 |
| ChemSpider | 22905 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Находится в природе в виде дигидрата CaSO4•2H2O (гипс, селенит) и в безводном состоянии — ангидрит.
При осторожном нагревании природного гипса, он частично обезвоживается и превращается в жженый гипс (CaSO4•0,5H2O) или алебастр.
Физические свойства
Безводный сульфат кальция — бесцветные кристаллы при нормальных условиях — с ромбической кристаллической решёткой, плотность 2,96 г/см³, температура плавления 1450 °C. При повышенных температурах (свыше 1200 °C) может существовать в виде стабильной кубической модификации или двух метастабильных α- и β-гексагональных модификаций. Очень медленно присоединяет воду, гидратируясь до кристаллогидрата с 1/2 или 2 молекулами воды на 1 молекулу сульфата, соответственно CaSO4 · 0,5H2О и CaSO4 · 2H2О. В воде растворим незначительно. Растворимость падает с повышением температуры: если при 20 °C она составляет 0,2036 г/100 г воды, то вблизи точки кипения воды (100 °C) снижается до 0,067 г сульфата на 100 г воды. Растворённый в природной воде сульфат кальция является одним из факторов, определяющих жёсткость воды.
Физические свойства двуводного сульфата кальция
При повышении температуры, но не более чем до 180 °C двуводный сульфат кальция теряет часть воды, переходя в полуводный — так называемый «жжёный гипс», пригодный для дальнейшего применения как вяжущее вещество. При дальнейшем нагреве до 220 °C гипс полностью теряет воду, образуя безводный CaSO4, который лишь при длительном хранении поглощает влагу и переходит в полугидрат. Если обжиг вести при температуре выше 220 °C, то получается безводный CaSO4, который влагу уже не поглощает и не «схватывается» при смешивании с водой (это вещество нередко называют «мёртвый гипс»). При дальнейшем нагревании до 900—1200 °C можно получить «гидравлический гипс», который после охлаждения вновь обретает свойства связываться с водой. Первый способ частичной дегидратиции применяют в промышленных условиях для получения полугидрата сульфата кальция (жжёного гипса, алебастра) CaSO4 ∙ 0,5H2O, нагревая дигидрат примерно до 140 °C, уравнение реакции: CaSO4 · 2H2О = CaSO4 · 0,5H2О + 1,5H2О.
Получение
В индустриальных масштабах добывают в составе природных минералов, например гипса, селенита или алебастра или получают синтетическим путём — сплавлением CaCl2 с K2SO4.
Может быть получен действием серной кислоты на оксид, гидроксид, карбонат, оксалат или ацетат кальция. Образуется в результате окисления сульфида кальция при нагреве до 700—800 °C по реакции CaS + 2O2 = CaSO4.
Применение
Значительные объёмы алебастра используются в строительстве (из него изготавливают сухую штукатурку, плиты и панели для перегородок, гипсовые камни, архитектурные детали и др.). Изделия из гипса характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью. Свойство алебастра затвердевать при смешении с водой нашло применение и в медицине, и в искусстве. «Это свойство гипса широко используют в ортопедии, травматологии и хирургии для изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела. Отвердевание замешанного с водой гипса сопровождается небольшим увеличением объёма. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используют скульпторы и архитекторы.» [2].
Безводный сульфат кальция в силу своих гигроскопичных свойств применяется как влагопоглотитель. Нередко с помощью специальных добавок ему в этом качестве придают дополнительные свойства. Так, осушитель Drierite, состоящий из ангидрата с добавкой хлорида кобальта, меняет свою изначально голубую окраску на розовую, что позволяет своевременно отследить момент исчерпания ресурса препарата.
Искусственные кристаллы сульфата кальция, легированные марганцем или самарием, применяются как термолюминесцентный материал.
Также находит применение в пиротехнике в качестве окислителя в осветительных составах, в смеси с алюминием или магнием в отношении гипс алюминий 1:1~2 в зависимости от требований. Используется как в порошкообразном так и в отверженном состоянии.
Сульфат кальция может применяться в качестве коагулянта, например, при изготовлении тофу.
В пищевой промышленности зарегистрирован в качестве пищевой добавки эмульгатора E516.
Регистрационный номер CAS:
Примечания
- http://www.cdc.gov/niosh/npg/npgd0095.html
- Химия вокруг нас. Строительные материалы. Книги. Наука и техника
- Common Chemistry — Substance Details — 7778-18-9 : Sulfuric acid, calcium salt (1:1)
- Common Chemistry — Substance Details — 10034-76-1 : Sulfuric acid, calcium salt, hydrate (2:2:1)
- Common Chemistry — Substance Details — 10101-41-4 : Sulfuric acid, calcium salt (1:1), dihydrate
