Сульфат железа(III)
Сульфат железа(III) (лат. Ferrum sulfuricum oxydatum) — неорганическое химическое соединение, соль, химическая формула — .
| Сульфат железа(III) | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
сульфат железа(III) |
| Традиционные названия | сернокислое железо(III), тетрасульфид(VI) железа(III) |
| Хим. формула | Fe2(SО4)3 |
| Рац. формула | Fe2(SO4)3 |
| Физические свойства | |
| Состояние | безводный — светло-жёлтый порошок |
| Молярная масса | |
| Плотность |
(безв.) 3.097 г/см³ (пентагидрат) 1.898 (нонагидрат) 2.1 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления |
(безв.) 480 °C (с разл.) (нонагидрат) 175 °C |
| • разложения | 600[1] |
| Мол. теплоёмк. | 271,75 Дж/(моль·К) |
| Энтальпия | |
| • образования | −2580 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде |
(безв.) растворим (нонагидрат) 440 г/100 мл |
| • в этаноле | (нонагидрат) растворим |
| Классификация | |
| Рег. номер CAS |
15244-10-7 (для всех гидратов с формулой Fe2(SО4)3·nН2О (где n=1, 3, 4, 6, 7, 9, 10, 12) |
| PubChem | 24826 |
| Рег. номер EINECS | 233-072-9 |
| SMILES | |
| InChI | |
| RTECS | NO8505000 |
| ChEBI | 53438 |
| ChemSpider | 23211 и 21493902 |
| Безопасность | |
| ЛД50 | (крысы, орально) 500 мг/кг |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Физические свойства
Безводный сульфат железа(III) — светло-жёлтые парамагнитные очень гигроскопичные кристаллы моноклинной сингонии, пространственная группа P21/m, параметры элементарной ячейки a = 0,8296 нм, b = 0,8515 нм, c = 1,160 нм, β = 90,5°, Z = 4. Есть данные, что безводный сульфат железа образовывает орторомбическую и гексагональную модификации. Растворим в воде, трудно растворим в этаноле[2].
Из воды кристаллизуется в виде кристаллогидратов Fe2(SO4)3·n H2O, где n = 12, 10, 9, 7, 6, 4, 3, 1. Наиболее изученный кристаллогидрат — нонагидрат сульфата железа(III) Fe2(SO4)3·9H2O — жёлтые гексагональные кристаллы, параметры элементарной ячейки a = 1,085 нм, c = 1,703 нм, Z = 4. Хорошо растворяется в воде (440 г на 100 г воды)[3]. В водных растворах сульфат железа(III) из-за гидролиза приобретает красно-коричневый цвет.
С аммиаком образует аддукт вида Fe2(SO4)3·n NH3, где n = 8, 12.
При нагревании нонагидрат превращается при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe2(SO4)3, который выше 600 °C разлагается на Fe2O3 и SO3.
Нахождение в природе
Минералогическая форма сульфата железа(III) — микасаит (англ. mikasaite), смешанный сульфат железа-алюминия. Его химическая формула — (Fe3+, Al3+)2(SO4)3. Этот минерал содержит безводную форму сульфата железа, поэтому встречается в природе очень редко. Гидратированные формы встречаются чаще, например:
- Кокимбит (англ. coquimbite) — Fe2(SO4)3·9H2O — нонагидрат — наиболее распространённая в природе форма.
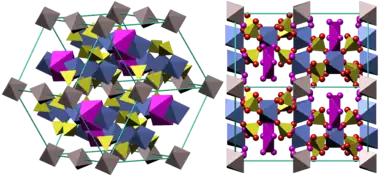
- Паракокимбит (англ. paracoquimbite) — другой нонагидрат — редкая форма.
- Корнелит (англ. kornelite) — гептагидрат — и куэнстедтит (англ. quenstedtite) — декагидрат — тоже встречаются редко.
- Лаусенит (англ. lausenite) — гекса- или пентагидрат (самостоятельность этого минерала под вопросом).
Все перечисленные выше природные гидраты железа на поверхности Земли нестабильны. Но их запасы постоянно пополняются благодаря окислению других минералов (в основном пирита и марказита).
Марс
Сульфат железа и ярозит были обнаружены двумя марсоходами: «Спирит» и «Оппортьюнити». Эти вещества являются признаком сильных окислительных условий на поверхности Марса. В мае 2009 года «Спирит» застрял, когда ехал по мягкому грунту планеты и наехал на залежи сульфата железа, скрытые под слоем обычного грунта[4]. Вследствие того, что сульфат железа имеет очень низкую плотность, марсоход застрял настолько глубоко, что часть его корпуса коснулась поверхности планеты.
Получение
В промышленности сульфат железа(III) получают прокаливанием пирита или марказита с NaCl на воздухе:
или растворяют оксид железа(III) в серной кислоте:
В лабораторной практике сульфат железа(III) можно получить из гидроокиси железа(III):
Препарат той же чистоты можно получить окислением сульфата железа(II) азотной кислотой:
также окисление можно провести кислородом или оксидом серы:
Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа(III):
Дисульфид железа можно окислить концентрированной серной кислотой:
Сульфат-аммоний железа(II) (соль Мора) также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа(III), хрома(III), аммония и калия, и вода:
Сульфат железа(III) можно получить как один из продуктов термического разложения сульфата железа(II):
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа(III):
При нагревании пентагидрата до температуры 70—175 °C получается безводный сульфат железа(III):
Сульфат железа(II) можно окислить триоксидом ксенона:
Химические свойства
Сульфат железа(III) в водных растворах подвергается сильному гидролизу по катиону, при этом раствор окрашивается в красновато-коричневый цвет:
Горячая вода или пар разлагают сульфат железа(III):
Безводный сульфат железа(III) при нагревании разлагается:
Растворы щелочей разлагают сульфат железа(III), продукты реакции зависят от концентрации щёлочи:
Если с щёлочью взаимодействует эквимолярный раствор сульфатов железа(III) и железа(II), то в результате получится сложный оксид железа:
Активные металлы (такие как магний, цинк, кадмий, железо) восстанавливают сульфат железа(III):
Некоторые сульфиды металлов (например, меди, кальция, олова, свинца, ртути) в водном растворе восстанавливают сульфат железа(III):
С растворимыми солями ортофосфорной кислоты образует нерастворимый фосфат железа(III) (гетерозит):
Использование
- Как реактив при гидрометаллургической переработке медных руд.
- Как протрава при окраске тканей.
- При дублении кожи.
- Для декапирования нержавеющих аустенитных сталей, сплавов золота с алюминием.
- Как флотационный регулятор для уменьшения плавучести руд.
- В медицине используется в качестве вяжущего и кровоостанавливающего средства.
- В химической промышленности как окислитель и катализатор.
Примечания
- [www.xumuk.ru/spravochnik/460.html Сайт XuMuK.ru]. Дата обращения: 4 апреля 2010.
- Рипан, Четяну, 1972, с. 526.
- Кнунянц, 2013, с. 38.
- Kenneth Chang. Mars Rover’s 5 Working Wheels Are Stuck in Hidden Soft Spot (англ.). The New York Times (19 мая 2009). Дата обращения: 25 апреля 2011. Архивировано 22 апреля 2012 года.
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Кнунянц И.Л. Краткая химическая энциклопедия. — М.: Рипол Классик, 2013. — 548 с.
