Стабилизация синапса
Эта страница описывает процесс стабилизации синапсов, опосредованный молекулами клеточной адгезии. Чтобы увидеть связанные статьи, пожалуйста, посетите следующие страницы: Синаптическая пластичность, молекулы клеточной адгезии.
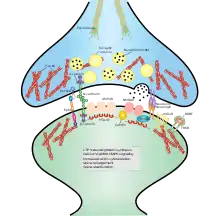
Стабилизация синапса — критически важный процесс как в формирующейся, так и во взрослой нервной системе, который является результатом поздней фазы долговременной потенциации. Механизмы этого процесса включают в себя укрепление и поддержание активных синапсов (через увеличение экспрессии элементов цитоскелета и внеклеточного матрикса, а также постсинаптических структурных белков, опосредующих сигнальные пути) и ликвидацию неактивных. Большую роль в стабилизации и поддержании структуры синапса играют молекулы клеточной адгезии (МКА). Джеральд Эдельман открыл МКА, и, изучая их функции, показал, что эти молекулы необходимы для осуществления процесса миграции клеток в частности, и формирования нервной системы в общем.[1][2] В сформировавшейся нервной системе синаптическая пластичность, касающаяся обучения и памяти, во многом зависит от работы молекул клеточной адгезии.[3]
Типы МКА
Синаптические МКА
Синаптические молекулы клеточной адгезии играют решающую роль в движении аксона во время его роста и установке синаптической связи между нейронами. Они являются неотъемлемыми участниками многих синаптических процессов, таких как правильная регуляция пре- и постсинаптических путей передачи сигнала, циркуляция везикул внутри синапса, интеграция постсинаптических рецепторов и установка элементов цитоскелета, обеспечивающих стабильность синапса как системы.[4]
Синаптические МКА (также известные как нектин-подобные молекулы) представляют собой особый тип синаптических молекул адгезии, найденных у позвоночных, которые способствуют росту и стабилизации возбуждающих (но не тормозных) синапсов. Синаптические МКА локализованы преимущественно в мозге на пре- и постсинаптических участках синапса; их структура включает в себя внутриклеточные белковые домены FERM (домен, опосредующий связь погруженного в мембрану белка с элементами цитоскелета) и PDZ (важный домен, состоящий из ~80 аминокислот, присутствующий у большинства сигнальных молекул, которые участвуют в процессах клеточной адгезии, и, как и FERM, способствующий связи белка с цитоскелетом), один трансмембранный домен и три внеклеточных иммуноглобулярных домена. Во время развития нервной системы, синаптические МКА, такие как SynCAM1, выступают в качестве контактных датчиков для аксонального конуса роста при формировании аксон-дендритных синапсов и стабильного комплекса адгезии.[5]
Наряду с нейролигинами, синаптические МКА — это такие типы молекул клеточной адгезии, которых оказывается достаточно для начала формирования пресинаптических окончаний, что было показано при добавлении этих молекул в среду совместно культивируемых нейрональных и не-нейрональных клеток, где они инициировали формирование пресинаптических терминалей. Связывание двух монофилетических МКА — одной на конусе роста аксона, а другой на дендритном шипике — приводит к установлению первоначального контакта между пре- и постсинаптическим нейронами. [6]
Синаптические МКА относятся к семейству белков-иммуноглобулинов, внедренных в постсинаптическую мембрану и взаимодействующих с постсинаптическим каркасным белком PSD-95, который помогает связать комплекс с подлежащим цитоскелетом. [7]
Кадгерин-катенин
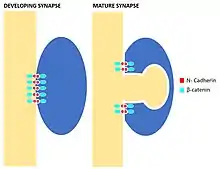
Кадгерины — кальций-зависимые, монофилетические молекулы клеточной адгезии, которые формируют комплексы с их внутриклеточными партнерами катенинами.[8] Компоненты этого комплекса связываюся с различными каркасными белками, фосфатазами, киназами и рецепторами. Классические кадгерины имеют пять внеклеточных повторяющиеся сайтов связывания кальция, один трансмембранный домен и внутриклеточный хвост с дистальным, уходящим в цитозоль доменом, который связывает катенин.[9][10] Недавние работы показали роль кадгерин-катенинового комплекса в различных процессах центральной нервной системы, таких как синаптическая стабилизация и синаптическая пластичность.
Многие кадгерины в ЦНС демонстрируют различные пространственные и временные паттерны экспрессии. Например, N-кадгерин широко выражен в развивающихся синапсах, и, позже, остается у зрелой активной зоны синапса, что подразумевает эффективность этого комплекса как посредника, реагирующего на изменения внутри синапса и т. о. регулирующего его стабильность. В самом деле, локальные изменения синаптической активности оказывают влияние на экспрессию кадгерин-катениновых комплексов. Увеличение активности в конкретном дендритном шипике ведет к димеризации N-кадгерина, который затем расщепляется, приводя к ингибированию действия клеточных факторов транскрипции. Это ингибирование оказывает существенное влияние на синаптическую пластичность.
В случае формирования дендритных шипиков и их дальнейшего прунинга, была предложена и подтверждена нижеследующая гипотеза.[11][12] Эта гипотеза предполагает, что то, как распределяются между шипиками кадгерин-катениновые комплексы (распределение зависит от функциональной активности шипиков), детерминирует судьбу каждого отдельного дендритного шипика. То есть, внутришипиковая конкуренция за β-катенин определяет, созреет данный шипик или подвергнется отрицательному прунингу. Это является важнейшим механизмом при «процессинге» корковых сетей и происходит на протяжении всего развития нервной системы.
Нектин
Нектины являются отдельным белковым семейством молекул клеточной адгезии. Эти МКА участвуют в инициации контакта пресинаптического и постсинаптического отростков в процессе образования синапса. В пределах синапса найдены и охарактеризованы 4 типа нектинов, соответственно Нектин-1, −2, −3 и −4.[13] Все связанные с мембраной нектины обладают внеклеточной областью с тремя иммуноглобулин-подобными петелями. Дистальная петля получила название петля V-типа, а две проксимальные петли — петли С2-типа. Несколько нектинов в пределах одной мембраны связываются друг с другом петлями V-типа, формируя кластер нектиновых белков; процесс носит название цис-кластеринг. Когда две клетки — каждая со своим цис-кластером — вступают в контакт, они образуют прочный комплекс (транс-кластер), который обеспечивает адгезию и, в некоторых случаях, сигнализацию между двумя клетками.[14]
Надежные сведения о роли нектинов в синаптической стабилизации получены из изучения синапсов между т. н. волокнами Моссье и дендритами пирамидных клеток в СА3-области гиппокампа.[15] Среди вышеупомянутых типов нектинов в формировании и стабилизации синапсов принимают участие Нектин-1 и Нектин-3, которые заякорены в постсинаптической и пресинаптической мембранах соответственно, где формируют друг с другом гетерофильные внеклеточные контакты. Внутриклеточный домен всех нектинов напрямую связывается с белком под названием L-афадин. L-Афадин — это актин-связывающий белок, который взаимодействует с F-актином актинового цитоскелета. Таким образом, нектины формируют жесткую актиновую каркасную систему, позволяя синапсу развиваться в контролируемой и стабильной среде.[16]
В процессе созревания синапсов в CA3-области гиппокампа, нектины и кадгерины, тесно связанные друг с другом в процессах синаптической стабилизации, смещаются на периферию активной зоны (места высвобождения нейротрансмиттеров) и формируют локальное место адгезии, т. н. Puncta Adherentia Junction (PAJ). PAJ-контакты очень похожи на те адгезионные контакты, которые наблюдаются в эпителиальных тканях. Формирование такого соединения обеспечивает формирующимся пре- и постсинаптическим мембранам пространство для взаимодействия, а в дальнейшем и надежную фиксацию на элементах цитоскелета.
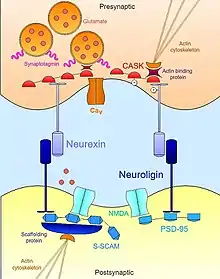
Нейрексин-нейролигин
Нейрексин-нейролигиновые взаимодействия помогают сформировать транс-синаптическую функциональную асимметрию, необходимую для стабилизации и поддержания нормальной передачи сигнала.[17] Белок пресинаптической мембраны нейрексин и его связующий партнер, белок постсинаптической мембраны нейролигин, связываются в комплекс на ранних стадиях развития нервной системы, и, как известно, являются мощными индукторами синаптогенеза.[18] Не-нейрональные клетки, которые искусственно экспрессируют нейрексин, способны индуцировать развитие постсинаптической специализации в совместно культивируемых нейрональных клетках;[19] пресинаптическую же специализацию в соседних нейронах стимулируют нейролигин-экспрессирующие клетки.[20][21] Однако, несмотря на важную роль обоих в процессах синаптогенеза, эти МКА не являются необходимыми для образования нейрональных связей в процессе развития нервной системы.[22] Трижды нокаутированные мыши с мутантными нейрексином и/или нейролигином демонстрировали нормальное количество синапсов, однако процессы синаптической передачи сигнала были нарушены ввиду экспрессии летального фенотипа на эмбриональном этапе развития.[23] Таким образом, нейрексин и нейролигин не нужны для образования синапсов per se, однако жизненно необходимы для созревания и интеграции синапсов в общую систему.
Помимо их внеклеточного связывания друг с другом, нейрексины и нейролигины внутриклеточно взаимодействуют с целой сетью адаптерных белков и каркасных структур, что, во взаимодействии с актиновым цитоскелетом, помогает правильно локализовать необходимые компоненты для осуществления синаптической передачи. Например, первый обнаруженный нейролигин (NLGN1), идентифицированный по его PDZ-домену, связанному с хорошо известным каркасным белком PSD95 в глутаматэргических синапсах, функционально связывает NMDA-рецепторы с локусом на постсинаптической мембране.[24] Схожим образом другая изоформа нейролигина (NLGN2) взаимодействует с каркасным белком гефирином, специфическим для ГАМК-эргических синапсов, и отвечает за активацию адаптерного синаптического белка коллибистина.[25] Внутриклеточные взаимодействия нейрексинов не менее важны в осуществлении важнейших механизмов синаптической передачи. Как и нейролигины, нейрексины обладают PDZ-доменом, связанным с кальций-кальмодулин-зависимой киназой. В дополнение к способности фосфорилировать саму себя и нейрексин, кальмодулин-зависимая киназа способствует взаимодействию между нейрексинами и актин-связывающими белками, обеспечивая прямую связь, посредством которой нейрексины модулируют динамику цитоскелета, что, в конечном итоге, имеет важное значение для синаптической пластичности и стабильности. Нейрексин может также связывать синаптотагмин, белок, встроенный в мембрану синаптических пузырьков; помимо этого, он способствует связыванию с потенциал-зависимыми кальциевыми каналами, которые опосредуют ионный ток, необходимый для экзоцитоза нейротрансмиттеров.[26] Таким образом, нейрексин и нейролигин координируют морфологические и функциональные аспекты синапса, что, в свою очередь, позволяет возникающим, незрелым контактам стабилизироваться в полноценные функциональные платформы для нейротрансмиссии.
Эфрин-Eph сигналинг
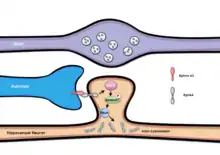
Нетрадиционные молекулы адгезии, таких как эфрины (семейство белков, являющихся лигандами eph-рецепторов), также играют свою роль в стабилизации синаптических контактов. Eph-рецепторы и их эфриновые лиганды вовлечены во множество различных клеточных процессов, протекающих во время развития и созревания организма, в том числе в процессы аксонального наведения, миграции нейронов, синаптогенеза и синаптического прунинга.[27][28] В гиппокампе морфология дендритных шипиков может регулироваться астроцитами через двунаправленный эфрин/Eph-сигналинг.[29] Астроциты и их отростки экспрессируют Эфрин-А3, в то время как гиппокампальные нейроны богаты рецепторами EphA4-типа. Это взаимодействие, опосредованное Эфрин-А3/EphA4-сигналингом, индуцирует отбор и активацию циклин-зависимой киназы 5 (Cdk5), которая затем фосфорилирует эфексин (ephexin1), один из факторов обмена гуаниновых нуклеотидов (GEFs).[30] Фосфорилированный, ephexin1 затем может активировать RhoA, малую ГТФазу, что приводит к последующей активации её эффектора, RhoA-киназы, в результате чего, в свою очередь, происходит перераспределение актиновых филаментов. С помощью этого механизма, астроцитарные отростки способны стабилизировать отдельные дендритные ветви, а также созревание их шипиков через ephrin/Eph-сигналинг. Интересно, что прямой сигналинг, включающий активацию EphA4, приводит к стабилизации синаптических белков в нервно-мышечных соединениях. Как и в EphA4/Эфрин-A3-опосредованном нейрон-глиальном взаимодействии, этот процесс регулирует динамику актинового цитоскелета посредством активации RhoA-киназы черeз эфексин.
Эфрин-B/EphB сигналинг также участвует в стабилизации синапса с помощью различных механизмов. Эти молекулы содержат цитоплазматические хвосты, которые взаимодействуют с каркасными белками через их PDZ-домены, стабилизируя новообразованные в ЦНС синапсы. Например, эфрин-B3, взаимодействуя с адаптерным белком глутаматных рецепторов (GRIP-1), регулирует развитие возбуждающих дендритных окончаний. Этот процесс, впервые исследованный в культуре гиппокампальных нейронов, показал, что обратный Eph/эфрин-B3 сигналинг приводит к связыванию GRIP1 с мембраной постсинаптического окончания.[31] Попадая на постсинаптическую мембрану, GRIP1 помогает закреплять на ней глутаматные рецепторы. Этот процесс также включает фосфорилирование серинового остатка вблизи карбоксильного конца эфрина-B (в проксимальном направлении к PDZ-связывающему мотиву), что приводит к стабилизации рецепторов АМРА-типа в синапсах.
Еще один механизм, обнаруженный в нейронах гиппокампа, показал, что EphB-сигналинг может способствовать созреванию дендритных шипиков путем регуляции активности ГТФазы Rho-типа, как это наблюдается с EphAs.[32] Но в отличие от EphAs, EphB2-рецепторы, как было показано, взаимодействуют с постсинаптическими NMDAR-рецепторами и, под воздействием эфрина-B, связывают в комплекс Tiam1, один из факторов обмена гуаниновых нуклеотидов.[33] Фосфорилирование Tiam1 происходит в ответ на активность NMDAR рецепторов, что дает дорогу притоку кальция, активирующему Tiam1. Этот механизм также может приводить к перестройкам в актиновом цитоскелете. Интересно, что в результате такой стабилизации и прямой EphB2-сигналинг, и обратный эфрин-B3-сигналинг приводят к эффекту долговременной потенциации через NMDAR рецепторы.[34]
Ссылки
- Rutishauser U., Jessell T. M. Cell adhesion molecules in vertebrate neural development (англ.) // Physiological Reviews : journal. — 1988. — July (vol. 68, no. 3). — P. 819—857. — doi:10.1152/physrev.1988.68.3.819. — PMID 3293093.
- Gerald M. Edelman biography. Nobelprize.org. Дата обращения: 13 марта 2018.
- Benson D. L., Schnapp L. M., Shapiro L., Huntley G. W. Making memories stick: cell-adhesion molecules in synaptic plasticity (англ.) // Trends in Cell Biology : journal. — Cell Press, 2000. — November (vol. 10, no. 11). — P. 473—482. — doi:10.1016/S0962-8924(00)01838-9. — PMID 11050419.
- Bukalo, Olena; Dityatev, Alexander. Synaptic Plasticity Dynamics Development and Disease (англ.). — Vienna: Springer, Vienna, 2012. — P. 97—128. — ISBN 978-3-7091-0932-8.
- Biederer, Thomas; Missler, Markus; Südhof, Thomas Synaptic Cell Adhesion. Cold Springs Harbor Perspectives in Biology. Cold Spring Harbor Laboratory Press. Дата обращения: 12 марта 2018.
- Washbourne, Philip; Dityatev, Alexander; Scheiffele, Peter; Biederer, Thomas; Weiner, Joshua A.; Christopherson, Karen S.; El-Husseini, Alaa. Cell Adhesion Molecules in Synapse Formation (англ.) // Journal of Neuroscience : journal. — 2004. — 20 October. — doi:10.1523/JNEUROSCI.3339-04.2004.
- Dalva, Matthew; McClelland, Andrew; Kayser, Matthew. Cell adhesion molecules: signalling functions at the synapse (англ.) // Nature : journal. — 2007. — 14 February. — doi:10.1038/nrn2075.
- Bamji S. X. Cadherins: actin with the cytoskeleton to form synapses (англ.) // Neuron : journal. — Cell Press, 2005. — July (vol. 47, no. 2). — P. 175—178. — doi:10.1016/j.neuron.2005.06.024. — PMID 16039559.
- Arikkath J., Reichardt L. F. Cadherins and catenins at synapses: roles in synaptogenesis and synaptic plasticity (англ.) // Trends in Neurosciences : journal. — Cell Press, 2008. — September (vol. 31, no. 9). — P. 487—494. — doi:10.1016/j.tins.2008.07.001. — PMID 18684518.
- Seong E., Yuan L., Arikkath J. Cadherins and catenins in dendrite and synapse morphogenesis (англ.) // Cell Adhesion & Migration : journal. — 2015. — April (vol. 9, no. 3). — P. 202—213. — doi:10.4161/19336918.2014.994919. — PMID 25914083.
- Whalley K. Neural development: a complex competition for spines (англ.) // Nature Reviews. Neuroscience : journal. — 2015. — October (vol. 16, no. 10). — P. 577. — doi:10.1038/nrn4024. — PMID 26307326.
- Bian W. J., Miao W. Y., He S. J., Qiu Z., Yu X. Coordinated Spine Pruning and Maturation Mediated by Inter-Spine Competition for Cadherin/Catenin Complexes (англ.) // Cell : journal. — Cell Press, 2015. — August (vol. 162, no. 4). — P. 808—822. — doi:10.1016/j.cell.2015.07.018. — PMID 26255771.
- Sanes, Dan. Development of the Nervous System (неопр.). — 3rd. — Elsevier, 2011. — ISBN 978-0-08-092320-8.
- Irie K., Shimizu K., Sakisaka T., Ikeda W., Takai Y. Roles and modes of action of nectins in cell-cell adhesion (англ.) // Seminars in Cell & Developmental Biology : journal. — 2004. — December (vol. 15, no. 6). — P. 643—656. — doi:10.1016/j.semcdb.2004.09.002. — PMID 15561584.
- Rikitake Y., Mandai K., Takai Y. The role of nectins in different types of cell-cell adhesion (англ.) // Journal of Cell Science : journal. — The Company of Biologists, 2012. — August (vol. 125, no. Pt 16). — P. 3713—3722. — doi:10.1242/jcs.099572. — PMID 23027581.
- Takai Y., Shimizu K., Ohtsuka T. The roles of cadherins and nectins in interneuronal synapse formation (англ.) // Current Opinion in Neurobiology : journal. — Elsevier, 2003. — October (vol. 13, no. 5). — P. 520—526. — doi:10.1016/j.conb.2003.09.003. — PMID 14630213.
- Craig A. M., Kang Y. Neurexin-neuroligin signaling in synapse development (англ.) // Current Opinion in Neurobiology. — Elsevier, 2007. — February (vol. 17, no. 1). — P. 43—52. — doi:10.1016/j.conb.2007.01.011. — PMID 17275284.
- Dean C., Dresbach T. Neuroligins and neurexins: linking cell adhesion, synapse formation and cognitive function (англ.) // Trends in Neurosciences : journal. — Cell Press, 2006. — January (vol. 29, no. 1). — P. 21—9. — doi:10.1016/j.tins.2005.11.003. — PMID 16337696.
- Nam C. I., Chen L. Postsynaptic assembly induced by neurexin-neuroligin interaction and neurotransmitter (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2005. — April (vol. 102, no. 17). — P. 6137—6142. — doi:10.1073/pnas.0502038102. — PMID 15837930.
- Brady, Scott T; Siegel, George J; Albers, R Wayne; Price, D. L. Basic neurochemistry : principles of molecular, cellular, and medical neurobiology (англ.). — Eighth. — Waltham, Massachusetts. — ISBN 978-0-12-374947-5.
- Missler M., Südhof T. C., Biederer T. Synaptic cell adhesion (неопр.) // Cold Spring Harbor Perspectives in Biology. — 2012. — April (т. 4, № 4). — С. a005694. — doi:10.1101/cshperspect.a005694. — PMID 22278667.
- Hortsch, Michael. A Short History of the Synapse – Golgi Versus Ramón y Cajal // The Sticky Synapse (неопр.) / Hortsch, Michael; Umemori, Hisashi. — Springer, New York, NY, 2009. — С. 1—9. — ISBN 978-0-387-92707-7. — doi:10.1007/978-0-387-92708-4_1.
- Missler M., Zhang W., Rohlmann A., Kattenstroth G., Hammer R. E., Gottmann K., Südhof T. C. Alpha-neurexins couple Ca2+ channels to synaptic vesicle exocytosis (фр.) // Nature : magazine. — 2003. — Juin (vol. 423, no 6943). — P. 939—948. — doi:10.1038/nature01755. — PMID 12827191.
- Squire, Larry R. Encyclopedia of neuroscience (неопр.). — Amsterdam: Academic Press, 2009. — ISBN 978-0-08-096393-8.
- Zhang C., Atasoy D., Araç D., Yang X., Fucillo M. V., Robison A. J., Ko J., Brunger A. T., Südhof T. C. Neurexins physically and functionally interact with GABA(A) receptors (англ.) // Neuron : journal. — Cell Press, 2010. — May (vol. 66, no. 3). — P. 403—416. — doi:10.1016/j.neuron.2010.04.008. — PMID 20471353.
- Hata Y., Davletov B., Petrenko A. G., Jahn R., Südhof T. C. Interaction of synaptotagmin with the cytoplasmic domains of neurexins (англ.) // Neuron : journal. — Cell Press, 1993. — February (vol. 10, no. 2). — P. 307—315. — PMID 8439414.
- Lisabeth E. M., Falivelli G., Pasquale E. B. Eph receptor signaling and ephrins (неопр.) // Cold Spring Harbor Perspectives in Biology. — 2013. — September (т. 5, № 9). — С. a009159. — doi:10.1101/cshperspect.a009159. — PMID 24003208.
- Bianchi, Lynne. Developmental Neurobiology (неопр.). — New York, NY: Garland Science, 2018. — С. 299—302. — ISBN 9780815344827.
- Bolton M. M., Eroglu C. Look who is weaving the neural web: glial control of synapse formation (англ.) // Current Opinion in Neurobiology : journal. — Elsevier, 2009. — October (vol. 19, no. 5). — P. 491—497. — doi:10.1016/j.conb.2009.09.007. — PMID 19879129.
- Rubenstein, John. Cellular Migration and Formation of Neuronal Connections: Comprehensive Developmental Neuroscience (англ.). — San Diego, CA: Elsevier Science & Technology, 2013. — P. 659—669. — ISBN 978-0-12-397266-8.
- Flannery D. B. Nondisjunction in Down syndrome (англ.) // American Journal of Medical Genetics : journal. — 1988. — September (vol. 31, no. 1). — P. 181—182. — doi:10.1101/gad.1973910. — PMID 2975924.
- Lerner A. M. Viral myocarditis as an incidental discovery (англ.) // Hospital Practice : journal. — 1990. — October (vol. 25, no. 10). — P. 81—4, 87—90. — doi:10.1016/j.brainres.2006.11.033. — PMID 2170431.
- Arvanitis D., Davy A. Eph/ephrin signaling: networks (англ.) // Genes & Development : journal. — 2008. — February (vol. 22, no. 4). — P. 416—429. — doi:10.1101/gad.1630408. — PMID 18281458.
- Lundgren A., Tibbling L., Henriksson N. G. DC-determined displacement of the nystagmus beat in rotatory tests (англ.) // Practica Oto-Rhino-Laryngologica : journal. — 2018. — March (vol. 31, no. 1). — P. 54—64. — doi:10.3892/etm.2018.5702. — PMID 5795627.