Спиропентан
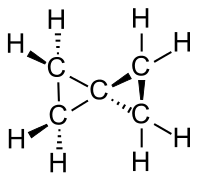
Спиропента́н (спиро[2.2]пентан) — углеводород с химической формулой C5H8, содержащий в своей структуре два спиросочлененных (соединенных через один атом углерода) циклопропановых фрагмента. Спиропентан является простейшим алициклическим соединением спиранового ряда [2][3][4][5].
| Спиропентан | |
|---|---|
 | |
| Общие | |
| Хим. формула | C5H8 |
| Термические свойства | |
| Температура | |
| • плавления | −134,6 °C[1] |
| Классификация | |
| Рег. номер CAS | 157-40-4 |
| PubChem | 9088 |
| SMILES | |
| InChI | |
| ChemSpider | 8734 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
После открытия спиропентана в 1887 году прошло несколько лет, прежде чем была определена структура молекулы[6][7][8].
Согласно правилам номенклатуры ИЮПАК для спиросоединений[9][10], систематическое название спиропентана — спиро[2.2]пентан. Однако у спиропентана не может быть других структурных изомеров, поэтому название, как правило, указывается без скобок и цифр.
История открытия
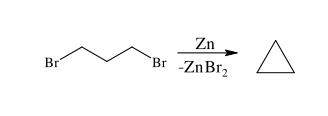
После того, как Густавсон Гавриил получил циклопропан путем взаимодействия 1,3-дибромпропана с измельченным металлическим цинком:
он попробовал провести ту же реакцию с 2,2-бис(бромметил)-1,3-дибромпропаном. Исходное вещество можно получить реакцией пентаэритрита с бромоводородной кислотой. В итоге, была получена молекула с формулой C5H8. В первоначальной публикации он назывался винилтриметиленом[11]. В 1907 году Фехт высказал предположение, что это должен быть спиропентан, структурный изомер винилциклопропана[12]. Дополнительное доказательство структуры углеводорода исходит из того факта, что он также может быть получен из 1,1-бис(бромметил)циклопропана[13]:
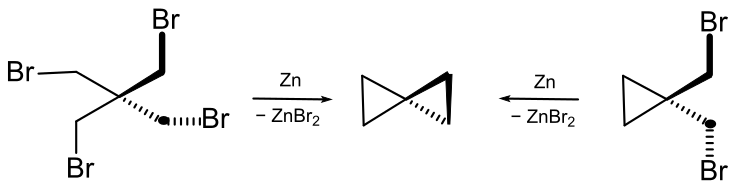
Спиропентан трудно отделить от побочных продуктов реакции, и первые реакции приводили к получению смесей продуктов. Спиропентан можно отделить от побочных продуктов (2-метил-1-бутена, 1,1-диметилциклопропана, метиленциклобутана) перегонкой[14].
Физические свойства
Структурный анализ с помощью дифракции электронов показал в спиропентане различие длины C—C-связей: связи с четвертичным («спиро») атомом углерода короче (146,9 пм), чем между метиленовыми группами (CH2–CH2, 151,9 пм).
Углы C–C–C при спироатоме C составляют 62,2°, что больше, чем в циклопропане[15].
Химические свойства
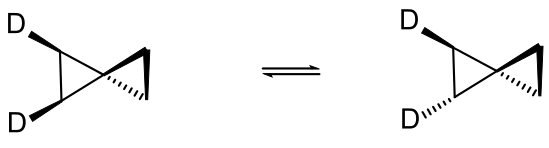
При нагревании молекул спиропентана, меченных атомами дейтерия, наблюдается реакция топомеризации или «стереомутации», аналогичная реакции циклопропана: цис-1,2-дидейтериоспиропентан находится в равновесии транс-1,2-дидейтериоспиропентаном[16].
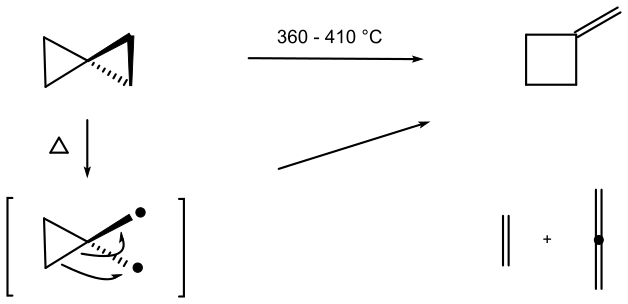
Густавсон в 1896 году сообщил, что нагрев спиропентана до 200 °C приводит к превращению в другие углеводороды. Термолиз в газовой фазе от 360 до 410 °C приводит к расширению цикла до структурного изомера метиленциклобутана вместе с продуктами фрагментации этеном и пропадиеном[17]. Предположительно, более длинная и более слабая связь разрывается первой, образуя бирадикальный интермедиат[16].
Примечания
- SPIROPENTANE (англ.) — 2007.
- Donohue, Jerry (1945). “The Structure of Spiropentane”. Journal of the American Chemical Society. 67 (2): 332—335. DOI:10.1021/ja01218a056. ISSN 0002-7863.
- Murray, M. J. (1944). “SPIROPENTANE”. Journal of the American Chemical Society. 66 (2): 314. DOI:10.1021/ja01230a515. ISSN 0002-7863.
- Murray, M. J. (1944). “The Debromination of Pentaerythrityl Bromide by Zinc. Isolation of Spiropentane1”. Journal of the American Chemical Society. 66 (5): 812—816. DOI:10.1021/ja01233a047. ISSN 0002-7863.
- Price, J.E. (2011). “High-resolution infrared spectra of spiropentane, C5H8”. Journal of Molecular Spectroscopy. 269 (1): 129—136. DOI:10.1016/j.jms.2011.05.011. ISSN 0022-2852.
- Philipow, O. (1916). “Die Konstitution der Kohlenwasserstoffe Gustavsons: Vinyltrimethylen und Äthylidentrimethylen”. Journal für Praktische Chemie. 93 (1): 162—182. DOI:10.1002/prac.19160930112. ISSN 0021-8383.
- Faworsky, Al. (1914). “Über das Vinyltrimethylen und Äthyliden-trimethylen von Gustavson”. Berichte der Deutschen Chemischen Gesellschaft. 47 (2): 1648—1651. DOI:10.1002/cber.19140470250. ISSN 0365-9496.
- Burns, G. R. (1972). “Infrared and Raman Spectra of Spiropentane-H8”. Applied Spectroscopy. 26 (5): 540—542. DOI:10.1366/000370272774351778.
- Определение спиросоединений по ИЮПАК (англ.). IUPAC - Spiro Compounds.
- G.P. Moss. Extension and Revision of the Nomenclature for Spiro Compounds (англ.) // Pure Appl. Chem. : журнал. — 1999. — Vol. 71, no. 3. — P. 531—558. — ISSN 1365—3075.
- Gustavson, G. (1896). “Ueber Aethylidentrimethylen”. Journal für Praktische Chemie. 54 (1): 104—107. DOI:10.1002/prac.18960540106. ISSN 0021-8383.
- Fecht, H. (1907). “Über Spirocyclane”. Berichte der Deutschen Chemischen Gesellschaft. 40 (3): 3883—3891. DOI:10.1002/cber.190704003194. ISSN 0365-9496.
- Zelinsky, N. (1913). “Über das Spirocyclan, seine Synthese und sein Verhalten bei der Reduktionskatalyse”. Berichte der Deutschen Chemischen Gesellschaft. 46 (1): 160—172. DOI:10.1002/cber.19130460128. ISSN 0365-9496.
- Applequist, Douglas E. (1958). “Chemistry of Spiropentane. I. An Improved Synthesis of Spiropentane”. The Journal of Organic Chemistry. 23 (11): 1715—1716. DOI:10.1021/jo01105a037. ISSN 0022-3263.
- G. Dallinga, R. K. van der Draai, L. H. Toneman, Recueil des Travaux Chimiques des Pays-Bas 87, 897 (1968).
- J. J. Gajewski, L. T. Burka, Journal of the American Chemical Society 94, Nr. 25, 8857 (1972).
- M. C. Flowers, H. M. Frey, Journal of the Chemical Society, 1961, 5550.