Ретромер
Ретроме́р — специализированный белковый комплекс, который собирается на эндосомах и образует везикулы, которые возвращают некоторые белки, например, рецепторы кислых гидролаз в аппарат Гольджи (точнее, транс-сеть Гольджи)[1][2][3].
Ретромерный комплекс был описан при изучении сортировки кислых гидролаз у мутантных дрожжей Saccharomyces cerevisiae, в частности, карбоксипептидазы Y (CPY). Он был идентифицирован как комплекс, отвечающий за ретроградный путь pro-CPY рецепторов (Vps10) из эндосом в транс-сеть Гольджи[4].
Структура
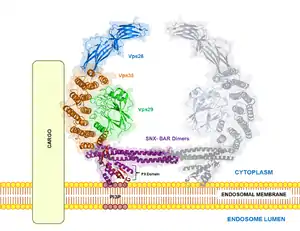
Ретромер человека представляет собой гетеропентамерный комплекс, который состоит из мембранных димеров сортирующего нексина (SNX1, возможно также SNX2, SNX5, SNX6) и вакуолярного белок-сортирующего тримера (англ. vacuolar protein sorting (Vps) trimer), в состав которого входят белки Vps26, Vps29 и Vps35. SNX необходим для привлечения ретромера к эндосомальной мембране; он имеет несколько различных белковых модулей, среди которых домен РХ, связывающийся с фосфорилированным фосфоинозитолом PI(3)P, и домен BAR, отвечающий за димеризацию и прикрепление к изогнутым мембранам (стоит отметить, что эти домены имеются и у других белков, у которых выполняют сходные функции). Связывание ретромерного комплекса с грузом обеспечивается коровым тримером через связывание Vps35 с различными молекулами груза (точнее, связывание последнего с цитоплазматическими хвостами транспортируемых мембранных белков)[5][6].
Ретромерный комплекс высококонсервативен, его гомологи были обнаружены у человека, мыши и нематоды Caenorhabditis elegans. У дрожжей он образован белками Vps35p, Vps26p, Vps29p, Vps17p, и Vps5p[7].
Механизм функционирования
Связывание комплекса Vps35-Vps29-Vps26 с цитозольными доменами молекул груза (трансмембранных белков в мембране эндосомы) инициирует активацию ретроградного пути и захват груза[8]. Комплекс нуклеации образуется при взаимодействии белков VPS совместно с GTP-активируемым белком Rab7 с клатрином, клатриновыми адаптерными белками и различными другими белками[9]. Димер SNX связывается с комплексом нуклеации непосредственно или в результате латерального перемещения по поверхности эндосомы. Это, в свою очередь, приводит к выпячиванию мембраны и образованию везикулы[10][11]. Когда комплекс ретромерных белков-переносчиков груза полностью сформируется, его катализ осуществляют белки DNM2 и EHD1[12]. Этому также способствует полимеризация актина и моторная активность. Доставка белка-переносчика к компартменту-реципиенту приводит к высвобождению переносчика за счет гидролиза ATP или GTP, осуществляемому Rab7. Далее белки-переносчики груза транспортируются в транс-Гольджи при помощи моторных белков, например, динеина. Высвобождающиеся далее комплекс Vps35-Vps29-Vps26 и димер SNX возвращаются в эндосомальные мембраны.
Функции
Ретромер играет центральную роль в возвращении нескольких различных белков из эндосом в транс-сеть Гольджи. Однако к настоящему моменту очевидно, что существуют и другие комплексы и белки, задействованные в этом процессе. Пока неясно, действуют ли они совместно с ретромером или по своему собственному пути. Было показано, что ретромерный комплекс участвует в возвращении в исходные мембраны различных мембранных рецепторов, например, катионзависимых[13] и катионнезависимых маннозо-6-фосфатных рецепторов (функциональный аналог млекопитающих дрожжевого рецептора Vsp10)[14], рецептора Wntless[15], задействованного в сигнальном пути Wnt, белка сортилин 1[16]. У дрожжей ретромер участвует в круговороте белков Kex2p и DPAP-A между транс-сетью Гольджи и превакуолярными компартменты (аналог эндосом у дрожжей). Ретромер также необходим для круговорота CED-1 — поверхностного клеточного рецептора, необходимого для фагоцитоза клеток, претерпевших апоптоз[17].
Недавно была показана роль дефектов ретромер-опосредованной сортировки белков при болезни Альгеймера[18] и болезни Паркинсона[19].
Примечания
- Альбертс и др., 2013, с. 1160—1161.
- Seaman M. N. Recycle your receptors with retromer. (англ.) // Trends in cell biology. — 2005. — Vol. 15, no. 2. — P. 68—75. — doi:10.1016/j.tcb.2004.12.004. — PMID 15695093.
- Pfeffer S. R. Membrane transport: retromer to the rescue. (англ.) // Current biology : CB. — 2001. — Vol. 11, no. 3. — P. 109—111. — PMID 11231171.
- Seaman M. N., McCaffery J. M., Emr S. D. A membrane coat complex essential for endosome-to-Golgi retrograde transport in yeast. (англ.) // The Journal of cell biology. — 1998. — Vol. 142, no. 3. — P. 665—681. — PMID 9700157.
- Альбертс и др., 2013, с. 1161.
- Seaman M. N. Cargo-selective endosomal sorting for retrieval to the Golgi requires retromer. (англ.) // The Journal of cell biology. — 2004. — Vol. 165, no. 1. — P. 111—122. — doi:10.1083/jcb.200312034. — PMID 15078902.
- Wassmer T., Attar N., Bujny M. V., Oakley J., Traer C. J., Cullen P. J. A loss-of-function screen reveals SNX5 and SNX6 as potential components of the mammalian retromer. (англ.) // Journal of cell science. — 2007. — Vol. 120, no. Pt 1. — P. 45—54. — doi:10.1242/jcs.03302. — PMID 17148574.
- Nothwehr S. F., Ha S. A., Bruinsma P. Sorting of yeast membrane proteins into an endosome-to-Golgi pathway involves direct interaction of their cytosolic domains with Vps35p. (англ.) // The Journal of cell biology. — 2000. — Vol. 151, no. 2. — P. 297—310. — PMID 11038177.
- McGough I. J., Cullen P. J. Recent advances in retromer biology. (англ.) // Traffic (Copenhagen, Denmark). — 2011. — Vol. 12, no. 8. — P. 963—971. — doi:10.1111/j.1600-0854.2011.01201.x. — PMID 21463457.
- Shimada A., Niwa H., Tsujita K., Suetsugu S., Nitta K., Hanawa-Suetsugu K., Akasaka R., Nishino Y., Toyama M., Chen L., Liu Z. J., Wang B. C., Yamamoto M., Terada T., Miyazawa A., Tanaka A., Sugano S., Shirouzu M., Nagayama K., Takenawa T., Yokoyama S. Curved EFC/F-BAR-domain dimers are joined end to end into a filament for membrane invagination in endocytosis. (англ.) // Cell. — 2007. — Vol. 129, no. 4. — P. 761—772. — doi:10.1016/j.cell.2007.03.040. — PMID 17512409.
- Bhatia V. K., Madsen K. L., Bolinger P. Y., Kunding A., Hedegård P., Gether U., Stamou D. Amphipathic motifs in BAR domains are essential for membrane curvature sensing. (англ.) // The EMBO journal. — 2009. — Vol. 28, no. 21. — P. 3303—3314. — doi:10.1038/emboj.2009.261. — PMID 19816406.
- Walseng E., Bakke O., Roche P. A. Major histocompatibility complex class II-peptide complexes internalize using a clathrin- and dynamin-independent endocytosis pathway. (англ.) // The Journal of biological chemistry. — 2008. — Vol. 283, no. 21. — P. 14717—14727. — doi:10.1074/jbc.M801070200. — PMID 18378669.
- Arighi C. N., Hartnell L. M., Aguilar R. C., Haft C. R., Bonifacino J. S. Role of the mammalian retromer in sorting of the cation-independent mannose 6-phosphate receptor. (англ.) // The Journal of cell biology. — 2004. — Vol. 165, no. 1. — P. 123—133. — doi:10.1083/jcb.200312055. — PMID 15078903.
- Eaton S. Retromer retrieves wntless. (англ.) // Developmental cell. — 2008. — Vol. 14, no. 1. — P. 4—6. — doi:10.1016/j.devcel.2007.12.014. — PMID 18194646.
- Belenkaya T. Y., Wu Y., Tang X., Zhou B., Cheng L., Sharma Y. V., Yan D., Selva E. M., Lin X. The retromer complex influences Wnt secretion by recycling wntless from endosomes to the trans-Golgi network. (англ.) // Developmental cell. — 2008. — Vol. 14, no. 1. — P. 120—131. — doi:10.1016/j.devcel.2007.12.003. — PMID 18160348.
- Canuel M., Korkidakis A., Konnyu K., Morales C. R. Sortilin mediates the lysosomal targeting of cathepsins D and H. (англ.) // Biochemical and biophysical research communications. — 2008. — Vol. 373, no. 2. — P. 292—297. — doi:10.1016/j.bbrc.2008.06.021. — PMID 18559255.
- Chen D., Xiao H., Zhang K., Wang B., Gao Z., Jian Y., Qi X., Sun J., Miao L., Yang C. Retromer is required for apoptotic cell clearance by phagocytic receptor recycling. (англ.) // Science (New York, N.Y.). — 2010. — Vol. 327, no. 5970. — P. 1261—1264. — doi:10.1126/science.1184840. — PMID 20133524.
- Muhammad A., Flores I., Zhang H., Yu R., Staniszewski A., Planel E., Herman M., Ho L., Kreber R., Honig L. S., Ganetzky B., Duff K., Arancio O., Small S. A. Retromer deficiency observed in Alzheimer's disease causes hippocampal dysfunction, neurodegeneration, and Abeta accumulation. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2008. — Vol. 105, no. 20. — P. 7327—7332. — doi:10.1073/pnas.0802545105. — PMID 18480253.
- . — PMID 21763483.
Литература
- Б. Альбертс, А. Джонсон, Д. Льюис и др. Молекулярная биология клетки. — М.—Ижевск: НИЦ «Регулярная и хаотическая динамика», 2013. — С. 1160—1161. — ISBN 978-5-4344-0137-1.
