Ретиноевая кислота
Ретиноевая кислота — органическое вещество, метаболит витамина A1 (ретинола). Опосредует функции витамина A1, необходимые для роста и развития. Ретиноевая кислота необходима для хордовых животных от рыб до человека. В ходе раннего эмбрионального развития ретиноевая кислота образуется в особом регионе эмбриона и участвует в определении позиции эмбриона по передне-задней оси, действуя как межклеточная сигнальная молекула, направляющая развитие задней части эмбриона[2]. Ретиноевая кислота действует на Hox-гены, которые отвечают за детерминацию головного и хвостового отделов эмбриона на ранних стадиях развития[3].
| Ретиноевая кислота | |
|---|---|
  | |
| Общие | |
| Систематическое наименование |
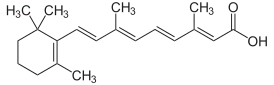
(2E,4E,6E,8E)-3,7-диметил-9-(2,6,6-триметилциклогексен-1-ил)нона-2,4,6,8-тетраеновая кислота |
| Хим. формула | C20H28O2 |
| Физические свойства | |
| Состояние | кристаллический порошок от жёлтого до светло-оранжевого цвета с характерным цветочным запахом[1] |
| Молярная масса | 300,43512 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 180-182 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | практически нерастворима в воде, |
| Классификация | |
| Рег. номер CAS | 302-79-4 |
| PubChem | 5538 |
| SMILES | |
| InChI | |
| ChEBI | 26536 |
| ChemSpider | 5337 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Основной изомер — транс-ретиноевая кислота по всем положениям, тогда как 13-цис- и 9-цис-ретиноевые кислоты представлены с гораздо меньшим уровнем[4]. Ключевая роль транс-ретиноевой кислоты в эмбриональном развитии объясняет высокий уровень тератогенности фармацевтических ретиноидов, таких как изотретиноин (13-цис-ретиноевая кислота), который используется при лечении рака и акне. Супервысокие пероральные дозы транс-рениноевой кислоты также обладают тератогенным действием по той же причине.
Механизм биологического действия
транс-Ретиноевая кислота действует путём связывания с рецептором ретиноевой кислоты (RAR), связанным с ДНК в виде гетеродимера с ретиноидным X рецептором (RXR) в областях, называемых RARE (retinoic acid response elements). Связывание ретиноевой кислоты с рецептором приводит к изменению конформации рецептора, связыванию других белков, что в конечном итоге вызывает индукцию или репрессию транскрипции соседних генов, включая Hox-гены и некоторые другие гены-мишени. Рецептор ретиноевой кислоты опосредует транскрипцию различных наборов генов, контролирующих дифференцировку различных типов клеток, причём регуляция генов зависит от типа клетки[5]. В некоторых клетках одним из генов-мишеней является ген самого рецептора, что в результате усиливает ответ[6]. Контроль за уровнем ретиноевой кислоты осуществляется целым рядом белков, которые участвуют в её синтезе и деградации[2][3].
Молекулярный механизм взаимодеятвия между транс-ретиноевой кислотой и Hox-генами изучался с на трансгенных животных с зелёным флуоресцентным белком в качестве репортёрного гена. Исследования идентифицировали рецепторы RARE, локализованные по соседству с некоторыми Hox-генами, включая Hoxa1, Hoxb1, Hoxb4, Hoxd4, что предполагает прямое взаимодействие между генами и ретиноевой кислотой[7].
Биосинтез
транс-Ретиноевая кислота может синтезироваться в организме в ходе двух последовательных реакций окисления транс-ретинола сначал в ретинальдегид (ретиналь), а затем в транс-ретиноевую кислоту. Однако обратная реакция не происходит и после образования ретиноевая кислота не может быть восстановлена до ретинальдегида. Ферменты, участвующие в биосинтезе ретиноевой кислоты, для регулирования уровня последней включают ретинолдегидрогеназу (Rdh10), которая метаболизирует ретинол в ретинальдегид, и три типа ретинальдегиддегидрогеназ: RALDH1 (ALDH1A1), RALDH2 (ALDH1A2) и RALDH3 (ALDH1A3)[8], которые метаболизируют ретинальдегид в ретиноевую кислоту[2]. Ферменты, которые метаболизируют избыток транс-ретинола для предотвращения его токсичности, включают алкогольдегидрогеназу и цитохром P450 (cyp26)[9].
См. также
Примечания
- Merck Index, 13th Edition, 8251.
- Duester G (September 2008). “Retinoic acid synthesis and signaling during early organogenesis”. Cell. 134 (6): 921—31. DOI:10.1016/j.cell.2008.09.002. PMC 2632951. PMID 18805086.
- Holland LZ (May 2007). “Developmental biology: a chordate with a difference”. Nature. 447 (7141): 153—5. Bibcode:2007Natur.447..153H. DOI:10.1038/447153a. PMID 17495912. Неизвестный параметр
|s2cid=(справка) - Rühl R, Krezel W, de Lera AR (December 2018). “9-Cis-13,14-dihydroretinoic acid, a new endogenous mammalian ligand of retinoid X receptor and the active ligand of a potential new vitamin A category: vitamin A5”. Nutrition Reviews. 76 (12): 929—941. DOI:10.1093/nutrit/nuy057. PMID 30358857.
- Venkatesh K, Srikanth L, Vengamma B, Chandrasekhar C, Sanjeevkumar A, Mouleshwara Prasad BC, Sarma PV (2013). “In vitro differentiation of cultured human CD34+ cells into astrocytes”. Neurology India. 61 (4): 383—8. DOI:10.4103/0028-3886.117615. PMID 24005729.
- Wingender, Edgar. Steroid/Thyroid Hormone Receptors // Gene Regulation in Eukaryotes. — New York : VCH, 1993. — P. 316. — ISBN 1-56081-706-2.
- Marshall H, Morrison A, Studer M, Pöpperl H, Krumlauf R (1996). “Retinoids and Hox genes”. The FASEB Journal. 10 (9): 969—978. DOI:10.1096/fasebj.10.9.8801179. PMID 8801179.
- ALDH 1 Family. Dr. Vasilis Vasiliou's laboratory at the University of Colorado's Health Sciences Center. Дата обращения: 22 октября 2012. Архивировано 13 января 2013 года.
- Molotkov A, Ghyselinck NB, Chambon P, Duester G (October 2004). “Opposing actions of cellular retinol-binding protein and alcohol dehydrogenase control the balance between retinol storage and degradation”. The Biochemical Journal. 383 (Pt 2): 295—302. DOI:10.1042/BJ20040621. PMC 1134070. PMID 15193143.