Нитрозамины
Нитрозамины (N-нитрозоамины) — органические соединения с общей формулой R1R2NNO, где R1, R2 — алкильный или арильный радикал. Известны также первичные нитрозамины (нестабильны, обычно не могут быть выделены в индивидуальном состоянии)[1] и их N-ацильные производные общей формулы RN(X)NO — нитрозамиды (X = COR) нитрозомочевины (X = CONR2), нитрозоуретаны (X = COOR) и пр.
Получение
Синтез нитрозаминов осуществляется введением нитрозо-группы во вторичные амины или амиды следующими реагентами:
- нитритом натрия в слабокислой среде,
- оксидом азота (III),
- оксидом азота (IV),
- NO2BF4.
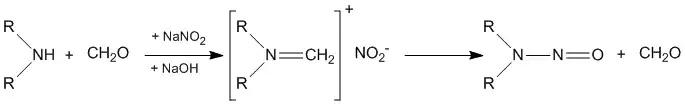
Нитрозамины получают также реакцией вторичных аминов с нитритом натрия и формальдегидом или хлоралем:
Строение
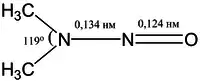
Атомы в молекулах нитрозаминов располагаются в одной плоскости. Строение молекулы простейшего органического нитрозамина (CH3)2NNO следующее:
Вращение по связи N−N сильно затруднено большим энергетическим барьером ΔG‡ = 75—190 кДж/моль).
В ультрафиолетовом спектре присутствуют 2 полосы λмакс = 360 нм (переход n → π, ε ~ 100) и λмакс = 230—255 нм (переход n → π, ε ~ 5000).
В ИК-спектре различаются 2 характеристические полосы для связи N=O (1430—1530 см−1) и связи N−N (~1000 см−1).
Физические и химические свойства
Первичные нитрозамины (R1 = H) — малоустойчивые вещества, стабильны только при температурах ниже 0 °C.
Нитрозамины являются жидкими или твёрдыми веществами жёлтого цвета, в индивидуальном виде малоустойчивы. Хорошо растворимы в воде и многих органических растворителях.
При действии восстановителей (водород на платине, палладии, LiAlH4) нитрозамины превращаются в производные гидразина. Действие более жёстких восстановителей (водород на никеле Ренея, амальгама натрия) на нитрозамины сопровождается разрывом связи N−N с образованием вторичных аминов.
Азотная и перфторпероксоуксусная кислоты окисляют нитрозамины в соответствующие N-нитрамины. Ангидриды органических кислот ацилируют нитрозамины, при этом происходит разрыв связи N−N. Действие хлороводорода также приводит к разрыву связи N−N.
К разрыву связи N−N и образованием радикала R2N· приводит и фотолиз нитрозаминов в парогазовой фазе.
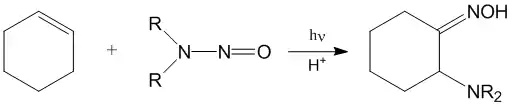
В жидкой фазе в кислой среде нитрозамины способны фотолитически присоединяться к алкенам:
Применение
Нитрозамины применяют для извлечения вторичных аминов из смесей, а также в синтезе некоторых лекарственных препаратов и органических красителей. В лабораторных синтезах нитрозамины применяют для получения диазоалканов.
Биологическая роль
Нитрозамины являются высокотоксичными соединениями. При попадании в организм они поражают печень, вызывают кровоизлияния, конвульсии, могут привести к коме. Большая часть нитрозаминов обладает сильным канцерогенным действием даже при однократном действии, проявляют мутагенные свойства. Напротив, N-нитрозо-N-метилмочевина обладает противоопухолевой активностью.
Нитрозамины в косметике
Нитрозамины могут встречаться в широком перечне косметической продукции и продуктах питания, но их не указывают на этикетках, так как они находятся в виде примесей (концентрация 1—3 ppm). Нитрозамины были обнаружены в 53 ингредиентах и более 10 тыс. продуктов, что позволяет составить примерный перечень добавок, где они встречаются, в том числе туши, кондиционерах для волос, детские и взрослые шампуни, бальзамы-ополаскиватели, лосьоны и кремы для загара, корректор и прочее. Нитрозамины образуются в косметике, когда при определённых условиях нитраты соединяются с различными аминокислотами (строительные блоки белков). В частности, когда аминоспирты типа диэтаноламина (DEA) или триэтаноламина (TEA) используются в продуктах в качестве консервантов, которые могут распадаться до нитратов. Так как эти различные соединения разрушаются с течением времени, они могут рекомбинироваться в нитрозамины. И DEA и TEA являются общими добавками, используемыми для регулирования рН или выступают в качестве увлажняющих агентов[2].
Литература
- Меди — Полимерные // Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1992. — Т. 3. — 639 с.
Примечания
- nitrosamines // IUPAC Gold Book.
- Impurities of Concern in Personal Care Products (недоступная ссылка). Skin Deep Cosmetics Database. EWG. Дата обращения: 23 марта 2019. Архивировано 23 марта 2019 года.
Ссылки
- Formation and occurrence of nitrosamines in food // Cancer Res. 1983 May; 43(5 Suppl):2435s—2440s.
- Nitrosamines // US CPCS, DECEMBER 23, 1983.
- Opinion on Nitrosamines and Secondary Amines in Cosmetic Products Scientific Committee on Consumer Safety, European Union, 2010 ISSN 1831-4767 ISBN 978-92-79-30741-6, doi:10.2772/4079, ND-AQ-12-001-EN-N.