Нитроанилины
Нитроанилины — органические вещества, производные анилина, первичные амины с общей формулой NO2—C6Н4—NН2 и молекулярной массой 138,13 г/моль.
Номенклатура
Нитроанилин имеет три изомера по относительному положению заместителей:
- Изомеры нитроанилина
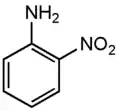 2-нитроанилин
2-нитроанилин
(о-нитроанилин,
1-амино-2-нитробензол) 3-нитроанилин
3-нитроанилин
(м-нитроанилин,
1-амино-3-нитробензол) 4-нитроанилин
4-нитроанилин
(п-нитроанилин,
1-амино-4-нитробензол)
Получение
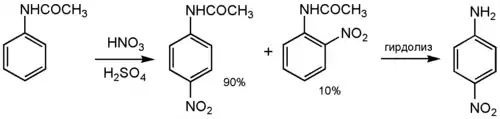
- Непосредственно действием азотной кислоты на анилин получить нитроанилин нельзя, так как аминогруппа при этом окисляется. Но если аминогуппу защитить ацилированием, то нитрование ацетанилина с последующим гидролизом приводит к образованию преимущественно п-нитроанилину:
- о-Нитроанилин и п-нитроанилин в промышленности получают нагреванием соответствующих 2- и 4-нитрохлорбензолов с аммиаком.
- м-Нитроанилин получают частичным восстановлением м-динитробензола дитионитом натрия, неверно называемым гидросульфитом натрия в зарубежной литературе.
Физические свойства
Нитроанилины — желтые кристаллы, хорошо растворяются в горячей воде, этаноле, диэтиловом эфире, бензоле, ацетоне, хлороформе, плохо — в холодной воде.
| Параметр | 2-нитроанилин | 3-нитроанилин | 4-нитроанилин |
|---|---|---|---|
| Внешний вид | оранжевые ромбические иглы (из этанола) |
желтые ромбические иглы (из этанола) |
желтые многогранные иглы (из этанола) |
| Т плав. °С | 71,5 | 111,8; 114 | 147,5; 149 |
| Т кип. °С | 284; 270 с разл.; 165 28 мм Hg | 305,7 с разл.; 100 0,16 мм Hg | 336 с разл.; 106 0,03 мм Hg |
| Плотность, г/см³ | 1,442 | 1,430 | 1,424 |
| Растворимость в воде, г/100 г растворителя |
0,126 25°С | 0,089 25°С | 0,08 19°С; 2,2 100°С |
| Растворимость в этаноле, г/100 г растворителя |
15,8 15°С; 27,87 25°С | 6,1 25°С | 4,61 |
| Растворимость в эфире, г/100 г растворителя |
легко растворим | 5,67 | 4,39 |
о-Нитроанилин образует кристаллы моноклинной сингонии, пространственная группа P 21/b, параметры a = 0,85 нм, b = 1,00 нм, c = 2,95 нм, β = 90°, Z = 16.
Химические свойства
- м-Нитроанилин — более сильное основание, чем остальные нитроанилины, он образует соли с сильными неорганическими кислотами, которые не гидролизуются водой. Константы диссоциации протонированных форм pKα: о-нитроанилина −0,29; м-нитроанилина 2,5; п-нитроанилина 1,02.
- Нитроанилины восстанавливаются водородом (железо в кислой среде) до соответствующих фенилендиаминов:
- NO2—C6Н4—NН2 + [H] → NH2—C6Н4—NН2 + H2O
- При нагревании с водными растворами щелочей группа NH2 у о-нитроанилина и п-нитроанилина замещается на ОН-группу с образованием нитрофенолов.
Применение
- в производстве синтетических красителей,
- в производстве синтетических смол,
- в текстильной промышленности, для крашения тканей под названиями: о-нитроанилин — азоамин оранжевый О, м-нитроанилин — азоамин оранжевый К и п-нитроанилин — азоамин красный Ж.
Токсичность
- Нитроанилины раздражают слизистые оболочки глаз и кожу, вызывают желтую пигментацию кожи и экзему, вредно действуют на сердечно-сосудистую и центральную нервную системы, функцию печени, превращают гемоглобин крови в метгемоглобин. ПДК для 2-нитроанилина 0,5 мг/м³, для 3- и 4-нитроанилинов 0,1 мг/м³.
- При введении в желудок — кратковременное возбуждение, нарушение координации движений, дрожание, судороги. ЛД50 для белых мышей: о-нитроанилин — 3,5 г/кг; м-нитроанилин — 0,9 г/кг; п-нитроанилин — 1,4 г/кг.
См. также
- N-нитроанилин
- Динитроанилины
- Тринитроанилины
- Тетранитроанилины
- Пентанитроанилин
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б. П. и др. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б. П. и др. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Несмеянов А. Н., Несмеянов Н. А. Начала органической химии. В 2-х томах. — М.: «Химия», 1970. — Т. 2. — 824 с.
- Общая органическая химия / Под ред. Бартон Д. — М.: «Химия», 1982. — Т. 3. — 738 с.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.