Нитрит калия
Нитри́т ка́лия (азотистокислый калий) — калиевая соль азотистой кислоты с формулой KNO2. Представляет собой белый или слегка желтоватый кристаллический гигроскопический порошок. Очень хорошо растворим в воде. На воздухе медленно окисляется до нитрата калия КNO3. Пищевая добавка E249. Используется как улучшитель окраски и консервант в пищевой промышленности в изделиях из мяса и рыбы.
| Нитрит калия | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Нитрит калия |
| Традиционные названия | Азотистокислый калий |
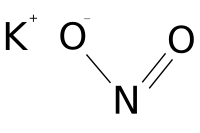
| Хим. формула | KNO2 |
| Физические свойства | |
| Состояние | прозрачные (белые) кристаллы |
| Молярная масса | 85,10 г/моль |
| Плотность | 1,915 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 387; 440; 441 |
| Химические свойства | |
| Растворимость | |
| • в воде | 2800; 413100 г/100 мл |
| • в этаноле | растворяется |
| Классификация | |
| Рег. номер CAS | 7758-09-0 |
| PubChem | 516910 |
| Рег. номер EINECS | 231-832-4 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E249 |
| RTECS | TT3750000 |
| ChemSpider | 22857 |
| Безопасность | |
| ЛД50 | 200 мг/кг (кролики, перорально) |
| Токсичность | токсичен (в больших количествах), нейротоксичен, является канцерогеном |
| Фразы риска (R) | R8, R25, R50, R40 |
| Фразы безопасности (S) | S45, S61 |
| Сигнальное слово | опасно |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Свойства
Нитрит калия образует бесцветные или слегка желтоватые высоко гигроскопичные кристаллы, моноклинной сингонии, пространственная группа I m, параметры ячейки a = 0,677 нм, b = 0,499 нм, c = 0,445 нм, β = 101,75°, Z = 2.
Очень хорошо растворим в воде, растворение сопровождается понижением температуры. Раствор имеет слабо щелочную реакцию из-за гидролиза по аниону.
Кристаллы разрушаются при 360 °C (до достижения точки плавления которая равна 440 °C или 441 °C, при 100 КПа по данным польской и английской Википедии и 438 °C при давлении в 101325 Па [1], энтальпия плавления — 17 кДж/моль[1]).
Выше этой температуры разлагается по схеме:
Как и нитрит натрия является окислителем особенно при повышенных температурах и реагирует с металлами такими как алюминий (особенно в порошкообразной форме), обезвоженными соединениями аммония такими как сульфат аммония, цианидами и многими органическими соединениями.
На воздухе медленно доокисляется до нитрата калия :
Нитриты можно выявить по характеристической реакции с сульфатом железа (II) в присутствии концентрированной серной кислоты (по образованию коричневого окрашивания).
Нахождение в природе и способы получения
В природе, нитриты появляются на промежуточных этапах азотного цикла — как при нитрификации (присоединении азота к соединениям) так и при денитрификации (отсоединении азота от соединений). В промышленности нитрит калия получают при реакции оксидов азота с гидроксидом калия.
Получается при окислении свинца нитратом калия:
или в процессе термического разложения:
Применение
- Нитрит калия как пищевая добавка Е249 (консервант) используется аналогично другим нитритам и солям (хлоридом натрия и нитритом натрия) — предотвращает образование ботулотоксина (образуется при жизнедеятельности палочки Clostridium botulinum). При добавлении к мясу образует нитрозомиоглобин, имеющий характерный красный цвет, который можно наблюдать в большинстве продуктов питания (колбасы, сосиски, и др.). Употребление продуктов, содержащих нитрит калия, вызывает жажду.
- В Европейском союзе продажа нитрита калия для пищевых целей разрешена только в виде смеси с пищевой солью, с содержанием нитрита около 0,6 %[2]. C 2013 года сходные правила действуют в России.
- Нитрит калия применяется для диазотирования при производстве азо-красителей.
- Нитрит калия применяется в аналитической химии для распознавания аминов.
- Нитрит калия применяется в фотографии как сенсибилизатор.
Биологическое действие

Токсичен при проглатывании, при получении больших доз вызывает раздражение, цианоз, конвульсии, смерть (образует метгемоглобин). Раздражает кожу и глаза. Летальная доза LD50 для кроликов 200 мг/кг[3][4].
Поступление нитритов с пищей оценивается в 31-185 или 40-100 мг в день[5].
В питьевой воде, согласно требованиям ВОЗ 1970 и 2004 гг[6][7], допускается содержание нитритов не более 44-50 мг на литр[8].
Приемлемые уровни потребления нитритов для людей 3,7 — 7 мг / кг.[8]
Примечания
- Физические величины: Справочник/А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др.; Под ред. И. С. Григорьева, Е. З. Мейлихова. — М.; Энергоатомиздат, 1991 −1232 с — ISBN 5-283-04013-5
- OPINIONS OF THE SCIENTIFIC COMMITTEE FOR FOOD ON: Nitrates and Nitrite / REPORTS OF THE SCIENTIFIC COMMITTEE FOR FOOD; European Commission, 1997
- Material Safety Data Sheet Potassium nitrite MSDS# 19480 Архивная копия от 8 августа 2016 на Wayback Machine. Fisher Scientific. 2005
- http://www.cdc.gov/niosh/ipcsneng/neng1069.html POTASSIUM NITRITE — The National Institute for Occupational Safety and Health (NIOSH), CDC
- Food sources of nitrates and nitrites: the physiologic context for potential health benefits Am J Clin Nutr July 2009 vol. 90 no. 1 1-10, doi:10.3945/ajcn.2008.27131. «DIETARY NITRATE AND NITRITE INTAKE ESTIMATES»
- World Health Organization. Recommendations; nitrate and nitrite. In: Guidelines for drinking water quality. 3rd ed. Geneva, Switzerland: WHO, 2004:417-20.
- Nitrate and nitrite in drinking-water (WHO/SDE/WSH/07.01/16/Rev/1), 2011
- Food sources of nitrates and nitrites: the physiologic context for potential health benefits Am J Clin Nutr July 2009 vol. 90 no. 1 1-10, doi:10.3945/ajcn.2008.27131. POTENTIAL HEALTH RISKS OF EXCESSIVE NITRATE AND NITRITE EXPOSURE
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- IARC Monographs on the Evaluation of Carcinogenic Risks to Humans VOLUME 94 "Ingested Nitrate and Nitrite, and Cyanobacterial Peptide Toxins", IARC, 2010 ISBN 978-92-832-1294-2, ISSN 1017-1606 (англ.)

